ASH 2019
7. bis 10. Dezember, Orlando
- Multiples Myelom 2019 – neue Wege der Myelomtherapie und Überwindung der Refraktärität
- Neues vom ASH-Kongress 2019 zur AML und MDS
- Indolente und aggressive Lymphome 2019 – Neues aus Orlando
 Vom 7. bis 10. Dezember fanden sich die weltweit renommiertesten Spezialisten auf dem Gebiet der Hämatoonkologie zur 61. Jahrestagung der American Society of Hematology (ASH) in Orlando, USA, ein. Dieser Kongress ist einer der wichtigsten Gradmesser für die aktuellen Fortschritte auf diesem Fachgebiet. Die Erwartungen sind hoch, was neue Impulse für die Diagnostik und die Therapie hämatoonkologischer Erkrankungen angeht. Überzeugen Sie sich selbst und freuen Sie sich auf die Highlights der ASH-Jahrestagung 2019 zu den Indikationen multiples Myelom, MDS/AML und der malignen Lymphome.
Vom 7. bis 10. Dezember fanden sich die weltweit renommiertesten Spezialisten auf dem Gebiet der Hämatoonkologie zur 61. Jahrestagung der American Society of Hematology (ASH) in Orlando, USA, ein. Dieser Kongress ist einer der wichtigsten Gradmesser für die aktuellen Fortschritte auf diesem Fachgebiet. Die Erwartungen sind hoch, was neue Impulse für die Diagnostik und die Therapie hämatoonkologischer Erkrankungen angeht. Überzeugen Sie sich selbst und freuen Sie sich auf die Highlights der ASH-Jahrestagung 2019 zu den Indikationen multiples Myelom, MDS/AML und der malignen Lymphome.
Liebe Kolleginnen und Kollegen,
wir freuen uns, Ihnen die zentralen Kernaussagen zu den aus unserer Sicht wichtigsten Neuigkeiten zu den Indikationen multiples Myelom, MDS/AML sowie den malignen Lymphomen von der 61. Jahrestagung der American Society of Hematology (ASH) vorstellen zu dürfen. Diese fand vom 7. bis 10. Dezember in Orlando statt.
Die Verbesserung der Therapieansätze in der Rezidivsituation, die Überwindung der Refraktärität, das Vorliegen reiferer Daten zu den CAR-T-Zell-Therapien sowie der Einsatz von neuen zielgerichteten Therapien waren Thema in den meisten Sitzungen im Kongresszentrum von Orlando.
Mit dem vorliegenden Bericht hoffen wir, Ihnen eine abwechslungsreiche Lektüre mit allen relevanten Fakten, die für Sie in Ihrem Klinik- und Praxisalltag wichtig sind, bieten zu können. Viel Freude beim Lesen.
Mit kollegialen Grüßen

Dr. med. Axel Nogai, Medizinische Klinik und Poliklinik für Hämatologie, Onkologie und Tumorimmunolo-gie, Charité Campus Benjamin Franklin, Berlin


Prof. Dr. med. Dimitrios Mougiakakos, Klinik für Innere Medizin 5, Hämatologie und Internistische Onkologie, Universitätsklinikum Erlangen
Multiples Myelom 2019 – neue Wege der Myelomtherapie und Überwindung der Refraktärität
Dr. med. Axel Nogai, Medizinische Klinik und Poliklinik für Hämatologie, Onkologie und Tumorimmunologie, Charité Campus Benjamin Franklin, Berlin
 Auch beim diesjährigen ASH-Kongress wurden wieder wichtige neue Daten zum multiplen Myelom (MM) präsentiert. Interessant war neben neuen Daten zu bereits etablierten Therapeutika insbesondere die klinische Einführung neuer Substanzen in den späteren, refraktären Therapielinien. Besondere Aufmerksamkeit fanden hierbei die CAR-T-Zellen. Gerade durch die einfachere Verfügbarkeit stellen aber gerade auch konjugierte BCMA(B-Cell Maturation Antigen)-Antikörper und bispezifische Konstrukte wie BCMA-BiTes(Bispecific T-Cell Engagers), sowie Substanzen wie etwa Selinexor ebenfalls wichtige Therapiealternativen dar, auch wenn diese noch nicht im Zentrum des Interesses stehen. Denn auch hier waren gute Ansprechraten zu beobachten. Mit den Daten zu Venetoclax zur Behandlung der Patienten mit MM, die eine t(11;14)-Translokation aufweisen, rückt erstmals eine zielgerichtete Therapie in den Fokus. Die Durchführung einer Zytogenetik beim MM wird somit obligat.
Auch beim diesjährigen ASH-Kongress wurden wieder wichtige neue Daten zum multiplen Myelom (MM) präsentiert. Interessant war neben neuen Daten zu bereits etablierten Therapeutika insbesondere die klinische Einführung neuer Substanzen in den späteren, refraktären Therapielinien. Besondere Aufmerksamkeit fanden hierbei die CAR-T-Zellen. Gerade durch die einfachere Verfügbarkeit stellen aber gerade auch konjugierte BCMA(B-Cell Maturation Antigen)-Antikörper und bispezifische Konstrukte wie BCMA-BiTes(Bispecific T-Cell Engagers), sowie Substanzen wie etwa Selinexor ebenfalls wichtige Therapiealternativen dar, auch wenn diese noch nicht im Zentrum des Interesses stehen. Denn auch hier waren gute Ansprechraten zu beobachten. Mit den Daten zu Venetoclax zur Behandlung der Patienten mit MM, die eine t(11;14)-Translokation aufweisen, rückt erstmals eine zielgerichtete Therapie in den Fokus. Die Durchführung einer Zytogenetik beim MM wird somit obligat.
Der folgende Bericht gibt einen Überblick über die interessantesten neuen Erkenntnisse vom diesjährigen ASH-Kongress. Es ist zu erwarten, dass vieles davon bald die Klinik erreichen wird und zu einer verbesserten Krankheitskontrolle insbesondere der fortgeschrittenen und bisher kaum zu kontrollierenden MMs führen wird.
Bestätigung guter Ergebnisse bei transplantablen Patienten
Die CASSIOPEIA-Studie (NCT02541383) konnte bereits den klinischen Nutzen von Daratumumab in Kombination mit Bortezomib, Thalidomid und Dexamethason bei fitten Patienten nachweisen. Damit bestätigte sich der Vorteil von Anti-CD38-Antikörpern auch in der Kombination mit einer Hochdosischemotherapie [1]. Auf dem diesjährigen ASH-Kongress wurden nun Daten zur Kombination von Daratumumab mit anderen Induktionsprotokollen vorgestellt.
In einem Update der GRIFFIN-Studie (NCT02874742) wurden die reiferen Daten zur Gabe von Daratumumab in Kombination mit RVd (Lenalidomid+Bortezomib+Dexamethason) gezeigt [2]. Die stringente komplette Remission (sCR) stellte den primären Endpunkt dar und dieser wurde erreicht. Die sCR konnte bei 42,4% der Patienten unter D-RVd (Daratumumab+RVd) gegenüber 32,0% der Patienten mit RVd alleine beobachtet (Odds Ratio [OR]: 1,57; 95-%-Konfidenzintervall [95-%-KI]: 0,87–2,82; zweiseitiger p-Wert = 0,1359) werden. Alle Subgruppen, außer der kleinen Patientengruppen mit ISS(International Staging System)-Stadium III oder Hochrisikozytogenetik, profitierten von der Therapie mit D-RVd. Aufgrund der nur kurzen Beobachtungsdauer kann bezüglich des progressionsfreien Überlebens (PFS) und des Gesamtüberlebens (OS) noch keine Aussage getroffen werden. Wie auch schon in anderen Studien zur Verwendung eines Anti-CD38-Antikörpers in der Induktion war die Stammzellsammlung nach der Gabe von Daratumumab weniger effizient. Es wurden statistisch gesehen weniger Stammzellen gesammelt (mediane Stammzellmenge 8,1 x 106 Zellen/kg Körpergewicht vs. 9,4 x 106 Zellen/kg Körpergewicht für D-RVd vs. RVd) und es musste häufiger Plerixafor appliziert werden. Zwar wurden für jeden Patienten ausreichend Stammzellen gesammelt, ob es hier im „Real Life“ aber nicht doch auch Ausfälle geben kann, bleibt noch abzuwarten. Die Frage ist, ob die Antikörper nicht auch erst in der Erhaltungstherapie appliziert werden könnten. Dagegen spricht jedoch die höhere Progressionsrate innerhalb der Induktion ohne Daratumumab (immerhin 8% bei RVd vs. 1% bei D-RVd). Die endgültige Beantwortung dieser Frage werden laufende vierarmige Studien, wie zum Beispiel die GMMG-HD7-Studie (NCT03617731) mit der randomisierten Gabe eines Anti-CD38-Antikörpers in der Induktion und/oder in der Erhaltungstherapie, liefern.
Nach dem Vorliegen der Metaanalyse zur Erhaltungstherapie mit Lenalidomid [3] hat sich diese aufgrund der verbesserten Gesamtüberlebensdaten endgültig als Standard etabliert. Von 2 Langzeitauswertungen der Myeloma-XI-Studie (NCT01554852), die auf diesem Kongress präsentiert wurden, wurde dieses Vorgehen bestätigt. Hierbei zeigte sich ein verbessertes PFS in der Population der transplantablen Patienten (medianes PFS: 64 Monate im Lenalidomid-Arm vs. 32 Monate im Kontrollarm; Hazard Ratio [HR]: 0,52; 95-%-KI: 0,45–0,61; p < 0,01). Von den 569 Patienten, die bisher rezidivierten, waren 254 im Lenalidomid-Arm und 315 im Kontrollarm. Der Zeitpunkt vom biochemischen Relapse bis zum Beginn der nächsten Therapielinie war in beiden Armen vergleichbar (6,3 Monate bis zum klinischen Progress bei Patienten nach Lenalidomid-Erhaltung vs. 8,1 Monate im Kontrollarm; HR 1,06; 95-%-KI: 0,87–1,29) [4]. Die Verbesserung des PFS bei der Erhaltungstherapie mit Lenalidomid war dabei unabhängig vom Risikostatus beziehungsweise der Zytogenetik der Patienten [5].
Dass die Etablierung neuer Substanzen auch im langfristigen Verlauf zu einer Prognoseverbesserung führt, wurde durch die Analyse der Langzeitdaten der HOVON-65/GMMG-HD4-Studie (EudraCT number 2004-000944-26) gezeigt [6]. Auch im langfristigen Verlauf bestätigte sich das Überwinden der schlechten Prognose einer del17p-Chromosomendeletion durch die Applikation von Bortezomib. Die Prognoseverschlechterung durch eine Niereninsuffizienz konnte durch die Verwendung einer bortezomibhaltigen Kombinationstherapie im Vergleich zu einer konventionellen Chemotherapie auch überwunden werden.
Gerade aufgrund der nun deutlich verbesserten Ansprechraten und der Dauer bis zum Rezidiv bei gleichzeitig multiplen Therapiemöglichkeiten wäre die Etablierung eines Surrogatmarkers wünschenswert, um die Studiendauern zu verkürzen und die benötigten Patientenzahlen zu verkleinern. Besondere Aufmerksamkeit liegt dabei auf dem MRD-Status. In der geplanten Phase-III-Studie AURIGA (NCT03901963) wird nun die randomisierte Gabe von Daratumumab zusätzlich zu einer Erhaltungstherapie mit Lenalidomid untersucht [7]. Der primäre Endpunkt soll hier die MRD-Negativität sein. Die Verwendung von klinisch nicht relevanten Surrogatmarkern stellt jedoch ein durchaus erhebliches Risiko dar. So waren gerade einige bei diesem Kongress vorgestellte Studien mit vielversprechenden Medikamenten in den primären Endpunkten negativ, im Verlauf zeigten die klinisch relevanten Parameter aber einen deutlichen Nutzen (VITAL-Studie [8], IxaDex-Studie [9]). Ob somit die Verwendung der MRD-Negativität als primärer Endpunkt sinnvoll ist, muss noch durch prospektive Studien mit einer gezielten Analyse der Prädiktabilität des MRD-Status untersucht werden.
Effektive Therapien auch für nicht transplantable Patienten
Während bisher das Ansprechen auf die Erstlinientherapien bei nicht transplantablen Patienten deutlich hinter dem Ansprechen nach einer Hochdosischemotherapie zurückblieb, scheint auch hier der Anti-CD38-Antikörper Daratumumab einen deutlichen Fortschritt zu bringen.
Mit der MAIA-Studie (NCT02252172) [10] zeigten sich Vorteile des Ansprechens und der Remissionsdauer, die bisher nur durch Hochdosischemotherapien erreicht wurden. Dies führte im November 2019 bereits zu einer Zulassung der Kombination von Daratumumab, Lenalidomid und Dexamethason (DRd) bei nicht transplantablen Patienten mit MM innerhalb Deutschlands. Für die MAIA-Studie wurde nun auf dem ASH-Kongress ein Update vorgestellt [11], in dem sich auch im längerfristigen Verlauf ein klinisch relevanter signifikanter Vorteil des PFS (medianes PFS mit DRd nicht erreicht vs. 33,8 Monate mit Rd [Lenalidomid+Dexamethason]; HR: 0,56; 95-%-KI: 0,44–0,71; p < 0,0001) zeigte (Abb. 1). Auffällig sind dabei die guten Daten des Vergleichsarms mit Rd: Hier ist das PFS verglichen mit anderen Studien mit Rd deutlich verlängert (z. B. FIRST-Studie [12]).

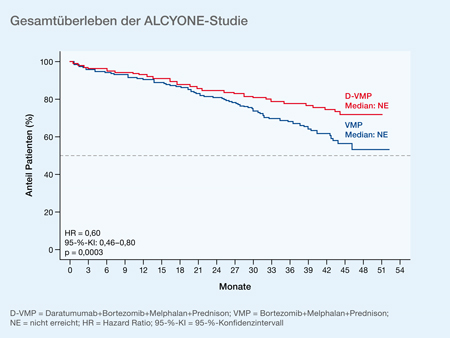
Die Effektivität eines Anti-CD38-Antikörpers in der Erstlinie ohne Hochdosistherapie wurde auch in der ALCYONE-Studie (NCT02195479 ) untersucht. Auf dem ASH-Kongress 2019 wurden nun reifere Daten mit einem signifikanten Überlebensvorteil gezeigt [13]. Bei einer medianen Beobachtungsdauer von 40 Monaten war das PFS mit D-VMP (Daratumumab+Bortezomib+Melphalan+Prednison) gegenüber VMP (Bortezomib+Melphalan+Prednison) alleine deutlich verbessert (medianes PFS: 36,4 Monate für D-VMP vs. 19,3 Monate für VMP; HR: 0,42; 95-%-KI: 0,34–0,51; p < 0,0001). Das OS nach 36 Monaten betrug 78% mit D-VMP versus 68% mit VMP (HR: 0,60; 95-%-KI: 0,46–0,80; p = 0,0003) (Abb. 2).
Während auf der einen Seite die Intensivierung der Therapien und somit eine erhöhte Effektivität der Myelomkontrolle im Vordergrund steht, stellen in der täglichen Praxis häufig die komorbiden älteren Patienten ein Problem dar. Denn viele von ihnen vertragen die Therapien nicht oder die Behandlungen können bei ihnen nicht angewandt werden. Gerade diese Patientengruppe ist in den Studien aber unterrepräsentiert. Daher gibt es für sie nur wenige wissenschaftlich begründete Therapiekonzepte. Erfreulicherweise zeichnete sich, was dies betrifft, auf dem diesjährigen ASH-Kongress eine Trendwende ab.
Die gute Wirksamkeit von Lenalidomid+Bortezomib+Dexamethason (RVd) wurde bereits in vorangegangenen Studien gezeigt [14]. Die Gabe dieser sehr effektiven Therapie in der Standarddosierung stellt für nicht fitte Patienten jedoch häufig eine Herausforderung dar. Für diese Patientengruppe erfolgte in einer Phase-II-Studie eine Reduktion der Dosierungen [15] mit 9 Zyklen Bortezomib 1,3 mg/m² an Tag 1, 8, 15 und 22 s. c., Lenalidomid 15 mg an Tag 1 bis 21 p. o. und Dexamethason 20 mg gleichzeitig mit den Bortezomib-Gaben und am jeweiligen Folgetag. Durch dieses „RVd lite“-Regime konnte ein weiterhin gutes Ansprechen bei guter Verträglichkeit erzielt werden. Nach einer Beobachtungszeit von 61 Monaten lag das mediane PFS bei 41,9 Monaten, das mittlere OS war noch nicht erreicht. Jedoch entwickelten 62% der Patienten eine Polyneuropathie (ein Patient Grad 3, restliche Patienten Grad 1–2). Da die Inzidenz des MM im höheren Lebensalter zunimmt, ist die gezielte Untersuchung dieser Patientengruppe mit angepassten Therapieregimes sehr wünschenswert.
Fazit
- Bei transplantablen Patienten konnten die Ergebnisse vorangegangener Studien bestätigt werden.
- Bei älteren, nicht transplantablen Patienten zeigen sich relevante Verbesserungen der Effektivität durch die Verwendung eines Tripelregimes.
- Die zunehmende Anpassung therapeutischer Regime bei gebrechlichen Patienten ist sehr wünschenswert.
„Auch wenn dieses Jahr keine spektakulären Ergebnisse zur Erstlinientherapie gezeigt wurden, konnten vorangegangene Ergebnisse durch das Vorliegen von Langzeitdaten nun bestätigt werden.“ Dr. med. Axel Nogai
Therapie des Rezidivs
Aufgrund der häufig lang anhaltenden Remissionen nach einer Erstlinientherapie rückt die effektive Therapie der Rezidive mit häufig nur kurz anhaltenden Remissionen in den Vordergrund. Besonders bei refraktären, aggressiven Rezidiven decken neue Therapiemöglichkeiten einen dringenden Bedarf.
Gerade im Rezidiv konnte durch die CASTOR-Studie (letztes Update [16]) und die POLLUX-Studie (letztes Update [17]) der hohe Stellenwert dieser Therapien belegt werden. Beim diesjährigen ASH-Kongress wurden verschiedene Therapieregime in Kombination mit Daratumumab vorgestellt.
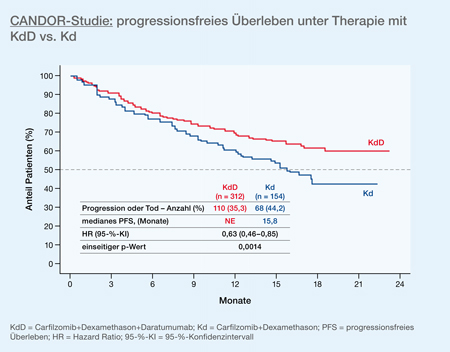
In der CANDOR-Studie (NCT03158688) [18] zeigte sich ein verbessertes PFS durch die Hinzunahme von Daratumumab (8 mg/kg i. v. an den Tagen 1 und 2 des ersten Zyklus und 16 mg/kg einmal wöchentlich für die verbleibenden Dosen der ersten 2 Zyklen, danach alle 2 Wochen über 4 Zyklen [Zyklus 3 bis 6] und danach alle 4 Wochen) zu Carfilzomib (als 30-minütige i. v. Infusion an den Tagen 1, 2, 8, 9, 15 und 16 in jedem 28-Tage-Zyklus mit 20 mg/m2 an den Tagen 1 und 2 während des ersten Zyklus, danach 56 mg/m2) und Dexamethason (40mg p.o./i.v. einmal wöchentlich, Patienten > 75 Jahre: 20mg). Der primäre Endpunkt, das PFS, war unter der Therapie mit KdD (Carfilzomib+Dexamethason+Daratumumab) signifikant verbessert (medianes PFS: nicht erreicht mit KdD vs. 15,8 Monate mit Kd [Carfilzomib+Dexamethason]; HR: 0,63; 95-%-KI: 0,46–0,85; p = 0,0014) (Abb. 3). Die Ergebnisse der Analyse der Lebensqualität stehen noch aus.
Aufgrund der zunehmenden Anwendung von Lenalidomid in der Erstlinie sowohl bei nicht transplantierbaren Patienten als auch in der Erhaltungstherapie nach einerTransplantation rücken Therapiealternativen zu Lenalidomid im Falle eines Rezidivs zunehmend in den Vordergrund. Hier stellt vor allem Pomalidomid eine Alternative dar. Zur Verbesserung der Ansprechraten wurden mehrere Studien zu Dreifachkombinationen mit Pomalidomid durchgeführt und auf dem diesjährigen ASH-Kongress vorgestellt.
Der Anti-CD38-Antikörper Isatuximab wurde in der ICARIA-MM-Studie (NCT02990338) in Kombination mit Pomalidomid+Dexamethason geprüft [19]. Daraus wurde nun die Subgruppenanalyse für die älteren Patienten präsentiert [20]. Ebenso wie die jüngeren Patienten hatten auch die Patienten ≥ 75 Jahre unter der Therapie mit Isatuximab+Pomalidomid+Dexamethason (Isa-Pd), verglichen mit den Patienten, die nur Pomalidomid+Dexamethason (Pd) erhielten, ein verbessertes PFS (medianes PFS: 11,40 Monate mit Isa-Pd vs. 4,47 Monate mit Pd; HR: 0,479; 95-%-KI: 0,242–0,946). Auch in der Untersuchung der Lebensqualität zeigte sich kein negativer Einfluss von Isatuximab, was die Effektivität dieser Therapie bei guter Verträglichkeit bestätigt [21].
Im Rahmen der OPTIMISMM-Studie (NCT01734928) wurde eine Kombination von Bortezomib+Dexamethason mit und ohne Pomalidomid getestet [22]. Auf dem ASH-Kongress 2019 wurden nun ebenfalls die Subgruppenanalysen bezüglich des Alters sowie vorangegangener Stammzelltransplantationen nach einer Vortherapie vorgestellt [23]. Hier zeigte sich sowohl bei den Patienten über 65 Jahre als auch bei den jüngeren Patienten ein signifikanter Vorteil im PFS und im Gesamtansprechen (ORR) der Dreifachkombinationstherapie Pomalidomid+Bortezomib+Dexamethason. Dieser signifikante Vorteil im PFS und ORR zeigte sich auch unabhängig vom Transplantationsstatus (vorangegangene Stamzelltransplantation ja/nein).
Auch die Kombination von Elotuzumab+Pomalidomid+Dexamethason zeigte ein gutes Ansprechen in der ELOQUENT-3-Studie (NCT02654132) [24]. Die gute Verträglichkeit von Elotuzumab wurde in einer auf dem ASH-Kongress gezeigten Analyse der Lebensqualität bestätigt [25]. Dies unterstreicht ebenfalls die gute Wirksamkeit der Kombinationstherapie bei gleichzeitig guter Verträglichkeit.
Die Gabe von Daratumumab ist eine effektive Strategie im Rezidiv. Die lange Infusionsdauer von Daratumumab und die begrenzten Therapieplätze bei dessen intravenöser Verabreichung können jedoch für die Patienten und die klinische Durchführbarkeit ein praktisches Problem darstellen.
Somit wäre die Etablierung einer subkutanen Therapie von Daratumumab durchaus eine deutliche Verbesserung. In einem Update der COLUMBA-Studie (NCT03277105) bestätigte sich auch im längerfristigen Verlauf die Nichtunterlegenheit der subkutanen Gabe [26]. Da hierbei eine feste Dosis appliziert wird, stellte sich die Frage, ob die Effektivität damit auch für Patienten mit höherem Körpergewicht erhalten bleibt. In der randomisierten Phase-III-Studie zur Nichtunterlegenheit wurde daher die Subgruppe der Patienten mit einem Körpergewicht von über 85kg analysiert [27]. Dabei ergab sich auch bei dieser Patientenpopulation kein Unterschied zwischen der körpergewichtsadaptierten i. v. Gabe und der s. c. Gabe einer festen Dosis.
In der Phase-I/IIb-STOMP-Studie (NCT02343042) wurden 48 Patienten mit fortgeschrittenem MM behandelt. Dabei wurde Selinexor mit Pomalidomid und Dexamethason kombiniert [28]. Das Ansprechen von 44 Patienten war auswertbar. Patienten, die zuvor kein Pomalidomid erhalten hatten (31 Patienten), zeigten ein Gesamtansprechen (ORR) von 58% (7 Patienten mit sehr gutem partiellem Ansprechen [VGPR], 11 partielle Remissionen [PRs]) bei einem medianen PFS von 12,2 Monaten. Patienten mit Refraktärität gegenüber Pomalidomid/Lenalidomid (n = 13) zeigten ein Gesamtansprechen von 31% (4 PR) bei einem medianen PFS von 4,2 Monaten. Die gute Wirksamkeit von Selinexor wird insbesondere von gastrointestinalen Nebenwirkungen begleitet (Übelkeit Grad 1/2 bei 56%, Gewichtsverlust Grad 1/2 bei 33%). Inwieweit das den Einsatz des Medikamentes limitiert, bleibt abzuwarten.
Die aktualisierten Ergebnisse der Phase-III-BELLINI-Studie (NCT02755597) wurden ebenfalls auf dem diesjährigen ASH-Kongress vorgestellt [29]. Sie verglich die Kombination von Venetoclax+Bortezomib+Dexamethason mit der Kombination aus Placebo+Bortezomib+Dexamethason. Trotz eines besseren Ansprechens (ORR: 84% vs. 70%, p = 0,009; ≥ VGPR: 61% vs. 40%, p < 0,001) und eines verbesserten medianen PFS (22,4 Monate vs. 11,5 Monate; HR = 0,630; p = 0,01) im Venetoclax-Arm zeigte sich dennoch ein schlechteres Gesamtüberleben im Vergleich zum Placebo-Arm (mittleres Gesamtüberleben in beiden Armen nicht erreicht; HR = 1,474; 95-%.KI: 0,870–2,498). 70 Patienten verstarben, davon 51 (26%) im Venetoclax-Arm und 19 (20%) im Placebo-Arm. Der Grund dafür waren insbesondere infektiöse Komplikationen.
In den Subgruppenanalysen [30] zeigte sich, dass Patienten mit t(11;14)-Translokation sowie mit BCL2-hochexprimierenden Myelomen (BCL2 aus der Familie der antiapoptotischen Proteine) von der Therapie profitieren. Somit wird hier die Zytogenetik des Myeloms erstmals als prädiktiver Parameter zur Therapieentscheidung Verwendung finden.
Die Studie wurde von der U.S. Food and Drug Administration (FDA) im März 2019 aufgrund eines erhöhten Anteils an Todesfällen im Venetoclax-Arm „on partial clinical hold“ gesetzt [31].
Fazit
- Im Rezidiv bestätigt sich die Effektivität von anti-CD38-basierten Antikörpertherapien (z. B. Daratumumab) bei guter Verträglichkeit. Alternative Anti-CD38-Antikörper sind kurz vor der Zulassung.
- Pomalidomid-basierte Triplettherapien nach Lenalidomid-Vortherapien sind sehr effektiv.
- Neue Therapiemöglichkeiten zeigen eine gute Wirksamkeit bei stark vorbehandelten Patienten.
- Die zielgerichtete Therapie zytogenetischer Aberrationen stellt eine Neuheit der Myelomtherapie dar.
“Gerade in der refraktären Situation und bei extramedullären Myelomen sind die neuen Therapien eine sehr wichtige Entwicklung.” Dr. med. Axel Nogai
Neue Therapieansätze mit CAR-T-Zellen
Auf ganz besonderes Interesse beim diesjährigen ASH-Kongress stießen die klinischen Daten zu den CAR-T-Zellen beim MM. Während bisher überwiegend sehr frühe Daten vorgestellt worden waren, konnten nun erste Aussagen über das PFS gemacht werden. Aktuell werden bereits mehrere CAR-T-Zell-Ansätze, die sich in der Art des CAR-Rezeptors sowie in der Art der Prozessoren zum Teil deutlich unterscheiden, in klinischen Studien umgesetzt.
Um die Persistenz der CAR-T-Zellen zu erhöhen, wird über eine Ex-vivo-Blockade der Phosphoinositid-3-Kinase (PI3K) die Differenzierung in Memory-T-Zellen induziert. Die so hergestellten bb21217-Anti-BCMA-CAR-T-Zellen der nächsten Generation wurden in der First-in-Human-Phase-I-Studie CRB-402 (NCT03274219) bei Patienten mit fortgeschrittenem MM eingesetzt [32]. In dieser zweiteiligen Studie zur Dosisfindung und -expansion sollen bis zu 74 Patienten eingeschlossen werden, die ≥ 3 Vortherapien erhalten hatten. Bisher konnten die Daten von 22 Patienten für diese vorläufige Analyse ausgewertet werden. Die Zahl der Vortherapien betrug im Mittel 7 (Spannweite: 4–17). 13 der 22 Patienten entwickelten ein Zytokinfreisetzungssyndrom (CRS), 5 Patienten eine Neurotoxizität. 15 Patienten (83%) zeigten ein Ansprechen bei einem Follow-up von ≥ 2 Monaten. Davon rezidivierten 6 Patienten im Verlauf. 9 Patienten befanden sich weiterhin in Remission. 6 Monaten nach der Therapie konnten bei 6 von 8 Patienten persistierende CAR-T-Zellen detektiert werden. 12 Monate nach der Therapie fanden diese sich noch bei 2 von 2 Patienten.
Im Rahmen der Phase-I-Studie CRB-401 (NCT02658929) wurde untersucht, welche Faktoren mit einem Ansprechen auf das CAR-T-Zell-Produkt Idecabtagen Vicleucel (Ide-Cel, bb2121) assoziiert sind [33]. Dabei wurde eine enge Korrelation zwischen dem Ansprechen und dem Serumspiegel des löslichen BCMA nach einer Infusion der CAR-T-Zellen identifiziert. Auch war vor der Einleitung der Therapie die Höhe des Spiegels des löslichen BCMA mit dem Serumspiegel des monoklonalen Proteins (M-Proteins) (ρ = 0,49; p = 0,03) und der Serumkonzentration der involvierten freien Leichtketten (ρ = 0,59; p = 0,005) assoziiert. Patienten, bei denen innerhalb von 7 Tagen das lösliche BCMA abfiel, zeigten ein gutes Ansprechen (mediane Reduktion von 50% bei ≥ Teilremission [PR] vs. medianer Anstieg um 27% bei Nichtansprechen [NR]; p = 0,02). Das lösliche BCMA scheint somit ein möglicher Biomarker für ein frühes sowie lang andauerndes Ansprechen auf Ide-Cel zu sein. Solche Daten können helfen, die Wirksamkeit von CAR-T-Zell-Therapien zu verbessern.
In der LEGEND-2-Studie (NCT03090659) wurden 57 Patienten mit rezidiviertem/refraktärem MM mit dem CAR-T-Zell-Produkt LCAR-B38M bis zum 31.12.2018 behandelt. Die ersten Daten wurden bereits publiziert [34]. Auf dem ASH-Kongress 2019 wurden nun die langfristigen Daten vorgestellt [35]. Auch hier entwickelten die meisten Patienten ein CRS (90%), wobei es sich meist (bei 82%) um eine Grad-1- oder -2-Nebenwirkung handelte. Die mittlere Zeit bis zum Auftreten eines CRS betrug 9 Tage (Spannweite: 1–19 Tage), die mittlere Dauer lag bei 9 Tagen (Spannweite: 3–57 Tage). Nur ein Patient entwickelte eine Neurotoxizität Grad 1. Bei 5 Patienten (9%) waren noch nach 10 Monaten im peripheren Blut CAR-T-Zellen nachweisbar. Die Gesamtansprechrate (PR oder besser) lag bei 88% (95-%-KI: 76–95). Eine CR wurde bei 42 Patienten (74%; 95-%-KI: 60–85) erreicht. Von diesen waren 39 MRD-negativ. In dieser Studie wurde kein Zusammenhang zwischen dem Ansprechen und dem BCMA-Expressionslevel gesehen.
Das mediane Follow-up lag bei 19 Monaten. Das OS nach 18 Monaten betrug 68% (Konfidenzintervall: 54–79%) – mit einer medianen Dauer des Ansprechens (mDOR) von 22 Monaten (Spannweite: 13–29 Monate). Die mDOR bei den MRD-negativen Patienten mit CR betrug 27 Monate (Konfidenzintervall: 16–NE). 26 Patienten (46%) waren weiterhin in Remission. Das PFS nach 18 Monaten lag bei 50% (Spannweite: 36–63 Monate). 17 Patienten verstarben während der Studie, davon hatten 11 Patienten eine Progression erlitten.
Die Durchführung dieser CAR-T-Zell-Studie erfolgte, wie inzwischen die meisten Studien zu dieser Thematik, in China. Hier erhielten die Patienten im Mittel deutlich weniger Therapielinien als in den USA oder in Europa. Es wurden nun auch Daten des CAR-T-Zell-Produktes JNJ-4528 (identisch mit dem LCAR-B38M-CAR-T-Zellprodukt) gezeigt, die in der CARTITUDE-1-Studie (NCT03548207) in den USA gewonnen worden waren [36]. 25 Patienten wurden mit Cyclophosphamid (300 mg/m²) und Fludarabin (30 mg/m²) über 3 Tage vorbehandelt. 5 bis 7 Tage später wurde das CAR-T-Zell-Produkt appliziert. Aktuell konnten die Daten von 21 Patienten ausgewertet werden. Im Mittel hatten die Patienten 5 Vortherapien (Spannweite: 3–16) erhalten, 88% der Patienten waren tripelrefraktär gegen Proteasominhibitoren, IMiDs und einen CD38-Antikörper. 72% waren pentaexponiert (2 IMiDs, 2 Proteasominhibitoren, ein CD38-Antikörper). 36% der Patienten waren pentarefraktär. Von der somit sehr stark vorbehandelten Patientengruppe entwickelten 88% ein CRS – davon ein Patient Grad 3 und ein Patient Grad 5. Im Mittel trat ein CRS 7 Tagen nach Gabe der CAR-T-Zellen auf. Die mittlere Dauer des CRS betrug 4 Tage (Spannweite: 1–60 Tage). 3 Patienten entwickelten eine Neurotoxizität, davon 2 Patienten Grad 1 und ein Patient Grad 3.
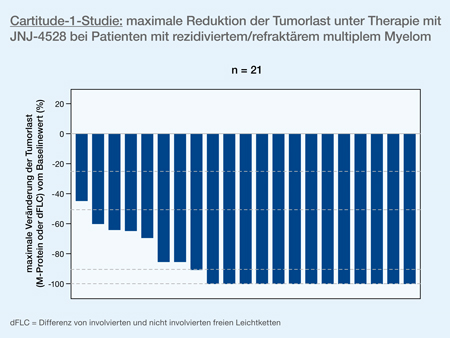
Die mittlere Beobachtungsdauer betrug 3 Monate (Spannweite: 1–10 Monate). 91% der Patienten zeigten ein Ansprechen – davon 4 sCRs, 2 CRs, 7 VGPRs und 6 PRs. Aufgrund der kurzen Beobachtungszeit kann noch keine Aussage zur Dauer des Ansprechens gemacht werden. Eine Reduktion der Tumorlast konnte bei allen 21 Patienten festgestellt werden (Abb. 4).
Trotz eines offensichtlich guten initialen Ansprechens scheint die Dauer des Ansprechens zumindest bei den weit fortgeschrittenen Myelomen dennoch begrenzt. Um die Ansprechdauer zu verbessern und in der Hoffnung, dass ein Plateau des Ansprechens erreicht werden kann, liegt das Hauptaugenmerk derzeit auf der Entwicklung optimierter Kombinationstherapien. Ein sehr vielversprechender Ansatz wurde nun von der Gruppe um Andrew Cowan aus Seattle vorgestellt [37]. Sie kombinierte BCMA-CAR-T-Zellen mit einem Gamma-Sekretaseinhibitor (JSMD194). Durch JSMD194 wird das Abspalten von BCMA von der Zelloberfläche gehemmt. Dadurch nimmt die Antigendichte auf den Myelomzellen zu. Auf diese Weise soll das Ansprechen verbessert werden. Nach einer 5-tägigen Gabe von JSMD194 erfolgte ein Staging anhand der BCMA-Expression auf den Tumorzellen im Knochenmarkaspirat. Anschließend wurden die BCMA-CAR-T-Zellen mit einer Gesamtanfangsdosis von 5 x 10^7 CAR-T-Zellen appliziert. JSMD194 wurde weiter 3 x/Tag über 3 Wochen appliziert. In der Analyse konnten die Daten von 7 Patienten ausgewertet werden. Alle Patienten waren stark vorbehandelt mit im Mittel 10 Vortherapien (Spannweite: 4–23). Ein Patient war refraktär auf eine vorangegangene BCMA-CAR-T-Zelltherapie, ein weiterer Patient hatte bereits einen bispezifischen BCMA-Antikörper erhalten. Unter der Vortherapie mit dem Gamma-Sekretaseinhibitor erhöhte sich die Anzahl der BCMA-exprimierenden Plasmazellen von 75% auf 99%. Das lösliche BCMA nahm um die Hälfte ab, und die BCMA-Antigendichte auf den Zellen nahm um das 20-Fache zu. Es konnten im Verlauf die Daten von 6 Patienten ausgewertet werden. Alle Patienten zeigten ein Ansprechen (ORR: 100%, davon 5 VGPRs und 1 PR), 5 der 6 Patienten waren MRD-negativ. Nach einer mittleren Beobachtungsdauer von 5 Monaten (Spannweite: 1–11 Monate) waren alle Patienten weiterhin in Remission. Alle Patienten entwickelten ein CRS, wobei ein Patient infolgedessen und aufgrund einer gleichzeitig vorliegenden Pilzinfektion an Tag 33 nach der CAR-T-Zell-Gabe verstarb. 70% der Patienten entwickelten eine Neurotoxizität.
Fazit
- CAR-T-Zellen stellen eine wichtige Erweiterung der Therapiemöglichkeiten beim multiplen Myelom dar.
- Die Ansprechraten sind ausgezeichnet, wobei sich allerdings bisher keine langfristigen Verläufe zeigen. Insbesondere findet sich kein Plateau.
- Kombinationstherapien scheinen somit notwendig. Die Kombination mit Gamma-Sekretaseinhibitoren ist ein möglicher Ansatz.
“Die Ergebnisse der CAR-T-Zelltherapien sind beeindruckend. Es bleibt zu hoffen, dass die langfristigen Ergebnisse durch verbesserte Produkte oder Kombinationen noch optimiert werden können.” Dr. med. Axel Nogai
Zusammenfassend kann man sagen, dass sich insbesondere in der Behandlung weit fortgeschrittener Myelome, auch extramedullärer und pentarefraktärer Myelome, erstaunliche Ergebnisse zeigen. Dies weckt die Hoffnung, dass zukünftig auch bei mehrfach rezidivierten Myelomen wieder langjährige Remissionen und Verläufe erzielt werden können. Vor allem die positiven Ergebnisse der CAR-T-Zellen standen in diesem Jahr im Vordergrund. Wegen der besseren Verfügbarkeit und der leichteren Standardisierbarkeit sind jedoch auch die Ergebnisse der BCMA-Antikörper beeindruckend. Sie werden sicherlich zeitnah Eingang in die klinische Praxis finden. Aber auch andere Substanzen konnten in solchen Situationen noch überzeugende Resultate erzielen.
Fazit
- Der Fokus der aktuellen Studien zielt insbesondere auf weit fortgeschrittene Myelome ab.
- Gerade die Ergebnisse bei Patienten mit extramedullären Myelomen sind beeindruckend, da für diese Patientenpopulation bisher keine wirksamen Therapien zur Verfügung standen.
“Auf dem diesjährigen ASH-Kongress zeichneten sich Verbesserungen in der Therapie der älteren, komorbiden Patienten sowie in der Behandlung der schwer zu therapierenden refraktären Patienten ab. Beides sind sehr wichtige Ergebnisse für den klinischen Alltag.” Dr. med. Axel Nogai
Quellen
- Moreau P et al. Bortezomib, thalidomide, and dexamethasone with or without daratumumab before and after autologous stem-cell transplantation for newly diagnosed multiple myeloma (CASSIOPEIA): a randomised, open-label, phase 3 study. The Lancet 2019; 394: 29-38.
- Voorhees P et al. Depth of Response to Daratumumab (DARA), Lenalidomide, Bortezomib, and Dexamethasone (RVd) Improves over Time in Patients (pts) with Transplant-Eligible Newly Diagnosed Multiple Myeloma (NDMM): Griffin Study Update. Presented at Session: 653. Myeloma: Therapy, excluding Transplantation: Therapeutics Questions in Newly Diagnosed Myeloma. ASH 2019, Orlando, abstract 691.
- McCarthy PL et al. Lenalidomide Maintenance After Autologous Stem-Cell Transplantation in Newly Diagnosed Multiple Myeloma: A Meta-Analysis. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2017; 35: 3279-3289.
- Pawlyn C et al. Lenalidomide Maintenance Prolongs Progression-Free Survival and Does Not Impact the Aggressiveness of Clinical Relapse: Data from Long-Term Follow up of the Myeloma XI Trial. ASH 2019, Orlando, abstract 1889.
- Jackson G et al. Lenalidomide Induction and Maintenance Maximizes Outcome for Newly Diagnosed Transplant Eligible Myeloma Patients Irrespective of Risk Status: Long-Term Follow-up of the Myeloma XI Trial. ASH 2019, Orlando, abstract 1910.
- Scheid C et al. Bortezomib-Based Induction and Maintenance Overcomes the Negative Prognostic Impact of Renal Impairment and del17p in Transplant-Eligible Myeloma Patients: Long Term Results from the Phase III HOVON-65/GMMG-HD4 Study after Median 137 Months Follow up. ASH 2019, Orlando, abstract 3308.
- Shah N et al. Daratumumab (DARA) Plus Lenalidomide Versus Lenalidomide Alone As Maintenance Treatment in Patients with Newly Diagnosed Multiple Myeloma (NDMM) after Frontline Autologous Stem Cell Transplant (ASCT): Use of Minimal Residual Disease (MRD) As a Novel Primary Endpoint in the Phase 3 Auriga Study. ASH 2019, Orlando, abstract 1829.
- Gertz M et al. Results of the Phase 3 VITAL Study of NEOD001 (Birtamimab) Plus Standard of Care in Patients with Light Chain (AL) Amyloidosis Suggest Survival Benefit for Mayo Stage IV Patients. ASH 2019, Orlando, abstract 3166.
- Dispenzieri A et al. Primary Results from the Phase 3 Tourmaline-AL1 Trial of Ixazomib-Dexamethasone Versus Physician’s Choice of Therapy in Patients (Pts) with Relapsed/Refractory Primary Systemic AL Amyloidosis (RRAL). ASH 2019, Orlando, abstract 139.
- Facon T et al. Daratumumab plus Lenalidomide and Dexamethasone for Untreated Myeloma. New England Journal of Medicine 2019; 380: 2104-2115.
- Bahlis N et al. Daratumumab Plus Lenalidomide and Dexamethasone (D-Rd) Versus Lenalidomide and Dexamethasone (Rd) in Patients with Newly Diagnosed Multiple Myeloma (NDMM) Ineligible for Transplant: Updated Analysis of Maia. ASH 2019, Orlando, abstract 1875.
- Facon T et al. Final analysis of survival outcomes in the phase 3 FIRST trial of up-front treatment for multiple myeloma. Blood 2018; 131: 301-310.
- Mateos M-V et al. Daratumumab Plus Bortezomib, Melphalan, and Prednisone Versus Bortezomib, Melphalan, and Prednisone in Patients with Transplant-Ineligible Newly Diagnosed Multiple Myeloma: Overall Survival in Alcyone. ASH 2019, Orlando, abstract 859.
- Durie BGM et al. Bortezomib with lenalidomide and dexamethasone versus lenalidomide and dexamethasone alone in patients with newly diagnosed myeloma without intent for immediate autologous stem-cell transplant (SWOG S0777): a randomised, open-label, phase 3 trial. Lancet (London, England) 2017; 389: 519-527.
- O`Donnell E et al. Updated Results of a Phase 2 Study of Modified Lenalidomide, Bortezomib, and Dexamethasone (RVd-lite) in Transplant-Ineligible Multiple Myeloma. ASH 2019, Orlando, abstract 3178.
- Spencer A et al. Daratumumab plus bortezomib and dexamethasone versus bortezomib and dexamethasone in relapsed or refractory multiple myeloma: updated analysis of CASTOR. Haematologica 2018; 103: 2079-2087.
- Dimopoulos MA et al. Daratumumab plus lenalidomide and dexamethasone versus lenalidomide and dexamethasone in relapsed or refractory multiple myeloma: updated analysis of POLLUX. Haematologica 2018; 103: 2088-2096.
- Usmani S et al. Carfilzomib, Dexamethasone, and Daratumumab Versus Carfilzomib and Dexamethasone for the Treatment of Patients with Relapsed or Refractory Multiple Myeloma (RRMM): Primary Analysis Results from the Randomized, Open-Label, Phase 3 Study Candor (NCT03158688). Presented at ASH 2019, Orlando, abstract LBA-6.
- Attal M et al. Isatuximab plus pomalidomide and low-dose dexamethasone versus pomalidomide and low-dose dexamethasone in patients with relapsed and refractory multiple myeloma (ICARIA-MM): a randomised, multicentre, open-label, phase 3 study. The Lancet 2019; 394: 2096-2107.
- Schjesvold F et al. Efficacy of Isatuximab with Pomalidomide and Dexamethasone in Elderly Patients with Relapsed/Refractory Multiple Myeloma: Icaria-MM Subgroup Analysis. ASH 2019, Orlando, abstract 1893.
- Houghton K et al. Health-Related Quality of Life in Patients with Relapsed/Refractory Multiple Myeloma Treated with Isatuximab Plus Pomalidomide and Dexamethasone: Icaria-MM Study. ASH 2019, Orlando, abstract 1850.
- Richardson PG et al. Pomalidomide, bortezomib, and dexamethasone for patients with relapsed or refractory multiple myeloma previously treated with lenalidomide (OPTIMISMM): a randomised, open-label, phase 3 trial. The Lancet Oncology 2019; 20: 781-794.
- Dimopoulos M et al. Pomalidomide + Bortezomib + Low-Dose Dexamethasone after 1 Prior Line of Therapy in Patients with Lenalidomide-Pretreated Multiple Myeloma: Subanalysis of the Phase 3 Optimismm Trial By Patient Age and Prior Stem Cell Transplant. ASH 2019, Orlando, abstract 3120.
- Dimopoulos MA et al. Elotuzumab plus Pomalidomide and Dexamethasone for Multiple Myeloma. New England Journal of Medicine 2018; 379: 1811-1822.
- Weisel K et al. Impact of Elotuzumab Plus Pomalidomide and Dexamethasone on Health-Related Quality of Life in Patients with Relapsed/Refractory Multiple Myeloma Enrolled in the ELOQUENT-3 Study. ASH 2019, Orlando, abstract 3480.
- Usmani S et al. Randomized, Open-Label, Non-Inferiority, Phase 3 Study of Subcutaneous (SC) Versus Intravenous (IV) Daratumumab (DARA) Administration in Patients with Relapsed or Refractory Multiple Myeloma: Columba Update. ASH 2019, Orlando, abstract 1865.
- Mateos M-V et al. Randomized, Open-Label, Non-Inferiority, Phase 3 Study of Subcutaneous (SC) Versus Intravenous (IV) Daratumumab (DARA) Administration in Patients (Pts) with Relapsed or Refractory Multiple Myeloma (RRMM): Body Weight Subgroup Analysis of Columba. ASH 2019, Orlando, abstract 1906.
- Chen C et al. Selinexor, Pomalidomide, and Dexamethasone (SPd) in Patients with Relapsed or Refractory Multiple Myeloma. ASH 2019, Orlando, abstract 141.
- Moreau P et al. Updated Analysis of Bellini, a Phase 3 Study of Venetoclax or Placebo in Combination with Bortezomib and Dexamethasone in Patients with Relapsed/Refractory Multiple Myeloma. ASH 2019, Orlando, abstract 1888.
- Harrison S et al. T(11;14) and High BCL2 Expression Are Predictive Biomarkers of Response to Venetoclax in Combination with Bortezomib and Dexamethasone in Patients with Relapsed/Refractory Multiple Myeloma: Biomarker Analyses from the Phase 3 Bellini Study. ASH 2019, Orlando, abstract 142.
- AbbVie Announces US FDA Lifts Partial Clinical Hold on Phase 3 Study of Venetoclax in Patients with Multiple Myeloma Positive for the t(11;14) Genetic Abnormality [Pressemitteilung]. Abgerufen am 20.12.2019.
- Berdeja J et al. Updated Results from an Ongoing Phase 1 Clinical Study of bb21217 Anti-Bcma CAR T Cell Therapy. ASH 2019, Orlando, abstract 927.
- Thompson E et al. Markers of Initial and Long-Term Responses to Idecabtagene Vicleucel (Ide-Cel; bb2121) in the CRB-401 Study in Relapsed/Refractory Multiple Myeloma. ASH 2019, Orlando, abstract 4328.
- Zhao WH et al. A phase 1, open-label study of LCAR-B38M, a chimeric antigen receptor T cell therapy directed against B cell maturation antigen, in patients with relapsed or refractory multiple myeloma. J Hematol Oncol 2018; 11: 141.
- Wang B-Y et al. Long-Term Follow-up of a Phase 1, First-in-Human Open-Label Study of LCAR-B38M, a Structurally Differentiated Chimeric Antigen Receptor T (CAR-T) Cell Therapy Targeting B-Cell Maturation Antigen (BCMA), in Patients (pts) with Relapsed/Refractory Multiple Myeloma (RRMM). ASH 2019, Orlando, abstract 579.
- Madduri D et al. Results from CARTITUDE-1: A Phase 1b/2 Study of JNJ-4528, a CAR-T Cell Therapy Directed Against B-Cell Maturation Antigen (BCMA), in Patients with Relapsed and/or Refractory Multiple Myeloma (R/R MM). ASH 2019, Orlando, abstract 577.
- Cowan A et al. Efficacy and Safety of Fully Human Bcma CAR T Cells in Combination with a Gamma Secretase Inhibitor to Increase Bcma Surface Expression in Patients with Relapsed or Refractory Multiple Myeloma. ASH 2019, Orlando, abstract 204.
- Bildnachweis: „Entrance to Orlando World Center Marriott Florida”: © imageegami/Adobe Stock; "Downtown Orlando from Lake Eola Park on a beautiful sunny Day": © susanne2688/Adobe Stock
Neues vom ASH-Kongress 2019 zur AML und MDS
Priv.-Doz. Dr. med. Thomas Schroeder, Universitätsklinikum Düsseldorf
 Die akute myeloische Leukämie (AML) und die myelodysplastischen Syndrome (MDS) stellten bei der 61. Jahrestagung der American Society of Hematology (ASH) 2019 in Orlando ein wichtiges Schwerpunktthema dar. Sie waren in zahlreichen Vortragssessions und sogar mit 2 Beiträgen in der Late-Breaking-Abstract-Sitzung vertreten. In einem dieser Beiträge konnte erstmals ein Benefit für eine Erhaltungstherapie bei der AML gezeigt werden. Ein weiterer Fokus der Tagung lag auf der Frage, wie die in den USA und teilweise auch in Europa zugelassenen neuen AML-Therapien mit zielgerichteten Substanzen, wie Venetoclax, Enasidenib, Ivosidenib, Gilteritinib und CPX-351, in Studien weiterentwickelt werden können beziehungsweise wie deren Wirk- und Resistenzmechanismen adressiert werden können, um ihren Einsatz im klinischen Alltag zu optimieren. Darüber hinaus wurden auch neue Therapieansätze, wie der gegen CD70-gerichtete Antikörper Cusatuzumab oder der TP53-Stabilisator APR-246, vorgestellt. Auch bei den MDS zeichnet sich eine zunehmend individualisierte Behandlung auf der Basis einer besser verstandenen Pathophysiologie ab, wobei teils zielgerichtete genotypische und teils neue immunologische Therapieansätze verfolgt werden.
Die akute myeloische Leukämie (AML) und die myelodysplastischen Syndrome (MDS) stellten bei der 61. Jahrestagung der American Society of Hematology (ASH) 2019 in Orlando ein wichtiges Schwerpunktthema dar. Sie waren in zahlreichen Vortragssessions und sogar mit 2 Beiträgen in der Late-Breaking-Abstract-Sitzung vertreten. In einem dieser Beiträge konnte erstmals ein Benefit für eine Erhaltungstherapie bei der AML gezeigt werden. Ein weiterer Fokus der Tagung lag auf der Frage, wie die in den USA und teilweise auch in Europa zugelassenen neuen AML-Therapien mit zielgerichteten Substanzen, wie Venetoclax, Enasidenib, Ivosidenib, Gilteritinib und CPX-351, in Studien weiterentwickelt werden können beziehungsweise wie deren Wirk- und Resistenzmechanismen adressiert werden können, um ihren Einsatz im klinischen Alltag zu optimieren. Darüber hinaus wurden auch neue Therapieansätze, wie der gegen CD70-gerichtete Antikörper Cusatuzumab oder der TP53-Stabilisator APR-246, vorgestellt. Auch bei den MDS zeichnet sich eine zunehmend individualisierte Behandlung auf der Basis einer besser verstandenen Pathophysiologie ab, wobei teils zielgerichtete genotypische und teils neue immunologische Therapieansätze verfolgt werden.
AML
Erstmals nachgewiesener Überlebensvorteil durch eine Erhaltungstherapie
Die Erhaltungstherapie bei der AML hat sich bisher aufgrund des fehlenden Nachweises eines Gesamtüberlebensvorteils als Bestandteil der AML-Behandlung nicht etablieren können. Lediglich Midostaurin ist für die Erhaltungstherapie nach einer konventionellen Induktion und einer Konsolidierung für Patienten mit FLT3-mutierter AML zugelassen. Allerdings hatte dabei die RATIFY-Studie den Stellenwert der Erhaltungstherapie auch nur als einen Teil der Gesamtbehandlung geprüft [1].
In der Late-Breaking-Abstract-Sitzung am Ende des Kongresses konnte nun erstmals ein isolierter Vorteil einer Erhaltungstherapie mit CC-486 – einer oral verfügbaren Form von Azacitidin – für das Gesamtüberleben nach einer konventionellen und intensiven Chemotherapie gezeigt werden [2]. In der internationalen, randomisierten doppelblinden placebokontrollierten QUAZAR-AML-001-Studie (NCT01757535) wurden zwischen 2013 und 2017 insgesamt 472 Patienten mit De-novo-AML oder sekundärer AML eingeschlossen, nachdem sie durch eine intensive Chemotherapie (Induktion, gefolgt von 1 bis 2 Zyklen Konsolidierung in knapp 80% der Fälle) eine Remission (81% komplette Remission [CR], 19% CR mit unvollständiger Erholung [CRi]) erreicht hatten und keine Kandidaten für eine allogene Transplantation waren. Die Patienten erhielten innerhalb von 4 Monaten nach der Remission randomisiert und 1:1-placebokontrolliert CC-486 einmal täglich (300 mg) für 14 Tage innerhalb eines 28-Tage-Zyklus. Die Therapie konnte fortgesetzt werden bis
- eine Unverträglichkeit eintrat,
- eine allogene Transplantation erfolgte oder
- ein Progress (definiert als > 15% Blasten) eintrat.
Im Falle eines Auftretens von > 5% bis 15% Blasten in Blut und Knochenmark konnte die Applikationsdauer auf 21 Tage innerhalb eines Zyklus ausgedehnt werden.
Nach einem medianen Follow-up von 41,2 Monaten zeigte sich sowohl für den primären Endpunkt Gesamtüberleben (24,7 vs. 14,8 Monate ab Randomisierung, p = 0,0009; Hazard Ratio 0,69 [95-%-KI: 0,55−0,86]) als auch für das rezidivfreie Überleben (RFS 10,2 vs. 4,8 Monate, p = 0,0001; Hazard Ratio 0,65 [95-%-KI: 0,52−0,81]) ein signifikanter Vorteil zugunsten des CC-486 (Abb. 1). Die Hauptnebenwirkungen des CC-486 waren gastrointestinale Beschwerden (vornehmlich Common Toxicity Criteria [CTC] Grad 1−2) sowie Neutropenien (CTC Grad 3−4, CC-486 41%; Placebo 24%), die mit Infektionen (CC-486 17%; Placebo 8%) assoziiert waren. Diese Nebenwirkungen führten jedoch lediglich bei 5% der Patienten zu einem Therapieabbruch und beeinträchtigten nicht die Lebensqualität.
„Eine orale Erhaltungstherapie mit CC-486 wird künftig für eine Gruppe vornehmlich älterer Patienten ohne Transplantationsoption die Behandlungsmöglichkeiten erweitern.“ PD Dr. med. Thomas Schroeder
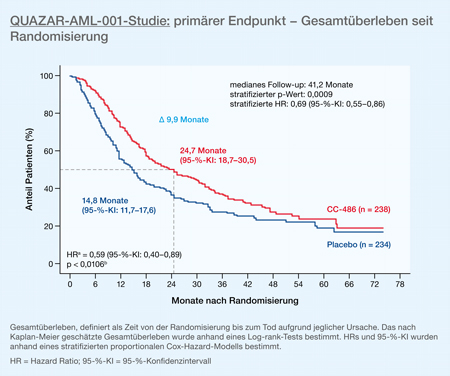
Abb. 1: Gesamtüberleben bei AML-Patienten unter einer Erhaltungstherapie mit CC-486 im Vergleich zu Placebo (modifiziert nach [2]).
Zielgerichtete AML-Therapien – es geht weiter voran
Die weitgehende Aufklärung der molekulargenetischen Veränderungen bei der AML hat die Entwicklung zielgerichteter Therapieansätze vorangetrieben. In Europa sind bisher nur der Multikinasehemmer Midostaurin und Gilteritinib als FLT3-Inhibitor zugelassen. Dahingegen wurden in den USA bereits die folgenden Substanzen teils als Mono- oder Kombinationstherapie, teils in der Erstlinienbehandlung oder in fortgeschrittener Therapielinie zugelassen (Abb. 2):
- die IDH-Inhibitoren Ivosidenib (IDH1) und Enasidenib (IDH2)
- Venetoclax als BCL2-Inhibitor
- Glasdegib aus der Gruppe der Hedgehog-Signalweg-Inhibitoren
Zahlreiche Beiträge auf dem diesjährigen ASH-Kongress zeigten nun, wie diese Substanzen in Studien weiterentwickelt werden beziehungsweise wie Wirk- und Resistenzmechanismen adressiert werden, um deren Einsatz im klinischen Alltag zu optimieren.
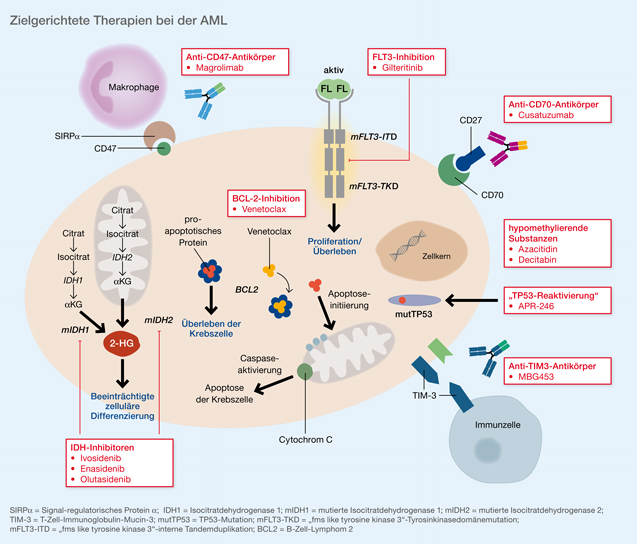
Abb. 2: Molekulargenetische Veränderungen bei der AML und den MDS sowie Angriffspunkte von molekular zielgerichteten Substanzen (modifiziert nach [3]).
Zu den neuen therapeutischen Optionen gehört auch die liposomale Formulierung von Cytarabin und Daunorubicin (CPX-351), welches seit dem letzten Jahr zur Behandlung der neudiagnostizierten, therapieassoziierten AML (t-AML) oder der AML mit MDS-assoziierten Veränderungen (AML-MRC) zugelassen ist. Eine Post-hoc-Analyse der Zulassungsstudie [4] untersuchte mittels einer 112-Genpanelanalyse der Blut- und Knochenmarkproben von 184 der 309 in der Studie behandelten Patienten (CPX-351-Arm n = 93, Standardarm n = 91), ob bestimmte Mutationen das Ansprechen und das Überleben unter einer Therapie mit CPX-351 beeinflussen [5]. Hierbei zeigte sich, dass es bei Patienten mit einer TP53-Mutation, die bei 33% der Patienten in der Kohorte nachgewiesen werden konnte, keinen Unterschied hinsichtlich der CR-Rate und des Gesamtüberlebens zwischen dem CPX-351- und dem Standardarm gab. Unter dem Vorbehalt der niedrigen Fallzahl und des limitierenden Post-hoc-Designs der Analyse scheint es, dass Patienten mit dieser prognostisch ungünstigen Mutation eher nicht von CPX-351 profitieren und innovative Therapiekonzepte in dieser Patientengruppe geprüft werden sollten (siehe Kapitel unten).
Kürzlich ist der Zweitgenerations-FLT3-Inhibitor Gilteritinib für die Behandlung von Patienten mit rezidivierter oder refraktärer AML mit FLT3-Mutation zugelassen worden. Die Grundlage dieser Zulassung war die ADMIRAL-Studie, in welcher eine orale Monotherapie mit Gilteritinib im Vergleich zu einer intensiven oder nichtintensiven Chemotherapie zu einer signifikant höheren CR-Rate und einem längeren Gesamtüberleben geführt hatte [6]. In dieser Studie lag die CR/CRi-Rate bei 34% infolge einer Therapie mit Gilteritinib und die mediane Remissionsdauer bei 11 Monaten. Dennoch verliert eine relevante Anzahl von Patienten im Verlauf das initiale Ansprechen wieder. Eine nun auf dem ASH-Kongress gezeigte Arbeit adressierte bei 40 Patienten, die im Verlauf der ADMIRAL-Studie rezidiviert waren, die zugrunde liegenden Resistenzmechanismen mittels einer vergleichenden 37-Genpanel-Analyse sowie einer Exomsequenzierung des gesamten FLT3-Gens von gepaarten Screening- und Rezidiv-Samples [7]. Es zeigte sich, dass 2/3 der Patienten zum Zeitpunkt des Rezidivs neue Mutationen erworben haben, welche vornehmlich Gene im RAS/MAP-Kinase-Signalweg betreffen. Dabei weisen zahlreiche Patienten sogar mehrere Mutationen in diesem Signalweg auf. Als einen weiteren Resistenzmechanismus konnten die Kollegen um Catherine C. Smith das Auftreten von neuen FLT3-Mutationen bei 15% der Patienten identifizieren. FLT3-Mutationen traten in keinem der Fälle gemeinsam mit RAS/MAPK-Kinase-Signalweg-Mutationen auf und sie bestanden in 5 von 6 Fällen in einer sogenannten F691L-Gatekeeper-Mutation, welche eine Resistenz gegenüber Erst- und Zweitgenerations-FLT3-Inhibitoren vermittelt. In Zukunft wird es im klinischen Alltag darauf ankommen, entsprechende Resistenzmechanismen im Falle eines verlorenen Ansprechens zu untersuchen, um gegebenenfalls alternative Therapien einzusetzen.
Neue Therapieansätze bei der AML
Neben den oben genannten zielgerichteten Substanzen wurden auf der diesjährigen Tagung der ASH auch neue vielversprechende Therapieansätze vorgestellt, die sich in früher klinischer Prüfung befinden und teilweise auch in Studien in Deutschland verfügbar sein werden.
Eine dieser Substanzen ist der monoklonale Antikörper Cusatuzumab, welcher gegen den Tumornekrosefaktor-Liganden CD70 gerichtet ist und die Bindung an dessen Rezeptor CD27 inhibiert. Sowohl CD70 als auch CD27 werden präferentiell auf leukämischen Stammzellen exprimiert und führen im Sinne einer autokrinen und parakrinen Stimulation zur Persistenz der leukämischen Stammzellen (LSC). Beide Moleküle werden jedoch nicht auf gesunden Blutstammzellen exprimiert und stellen somit ein interessantes therapeutisches Ziel dar. Die Blockade der Bindung zwischen CD70 und CD27 führt zu einer Induktion der myeloischen Differenzierung und zu einer Proliferationshemmung der LSC. Darüber hinaus wird durch den Antikörper die Freisetzung von löslichem CD27 gehemmt und eine antikörper- sowie eine komplementvermittelte Zytotoxizität induziert. Die Arbeitsgruppe um Adrian Ochsenbein konnte in einer parallel zu den klinischen Daten vorgestellten experimentellen Arbeit nun zeigen, dass hypomethylierende Substanzen eine Hochregulation von CD70 auf LSC vermitteln und dass dieser postulierte Resistenzmechanismus durch Cusatuzumab unterbrochen werden kann [8]. Aufgrund dessen wird die Substanz in einer aktuell noch laufenden Phase-I/II-Studie in Kombination mit Azacitidin bei älteren therapienaiven Patienten mit neudiagnostizierter AML getestet. Die Patienten erhalten zunächst eine 14-tägige Monotherapie mit Cusatuzumab, gefolgt von einer Therapie mit Azacitidin in der Standarddosis von 7 x 75 mg/m2 alle 28 Tage sowie alle 2 Wochen zusätzlich eine Gabe Cusatuzumab. Bisher sind 38 Patienten (12 in der Dosiseskalationsphase, 26 in der Dosisexpansionsphase) nach diesem Schema behandelt worden. Es zeigt sich eine akzeptable Verträglichkeit ohne nennenswerte besonders auffällige Nebenwirkungen. Die bisher gezeigten Ansprechraten der 12 Patienten in der Dosiseskalationsphase zeigen eine Rate an kompletten Remissionen und kompletten Remissionen mit inkompletter hämatopoetischer Regeneration von 83% (n = 10), wobei 5 der 9 untersuchten Patienten keinen durchflusszytometrischen Nachweis einer minimalen Resterkrankung mehr aufweisen. Diese Daten sind vielversprechend und lassen mit Spannung auf die endgültigen Resultate dieser Studie warten. Sie stellen außerdem die Grundlage für 2 geplante Studien dar (CULMINATE, NCT04150887). In diesen Untersuchungen, die auch in Deutschland durchgeführt werden sollen, sollen Patienten mit neudiagnostizierter AML, MDS und CMML mit Cusatuzumab als Teil einer Kombinationstherapie behandelt werden.
Zeit bis zum Beginn der Induktionschemotherapie ohne Einfluss auf Prognose
Angesichts der Verfügbarkeit von Midostaurin, CPX-351 und Gemtuzumab-Ozogamicin für die Erstlinientherapie der intensiv behandelbaren AML-Patienten ist eine zyto- und molekularbiologische Charakterisierung für die Therapiestratifizierung erforderlich. Diese nimmt aber in der Regel 1 bis 2 Wochen in Anspruch und steht somit in Konflikt mit dem bisherigen Paradigma, dass eine AML-Therapie unverzüglich nach der Diagnosestellung eingeleitet werden sollte. Aufgrund dessen hat die deutsche Studienallianz Leukämie (SAL) 2.263 Patienten mit neudiagnostizierter AML, die eine Induktionstherapie im Median nach 3 Tagen begonnen haben, hinsichtlich der Fragestellung, ob eine Therapieverzögerung von prognostischem Nachteil ist, untersucht [9]. Durch eine Einteilung in Patientengruppen, die 0−5, 6−10, 11−15 und > 15 Tage nach der Diagnosestellung behandelt wurden, konnten die Kollegen in uni- und multivariaten Analysen zeigen, dass eine Verzögerung der Therapie zu keinem Nachteil hinsichtlich der CR-Rate, der 30-Tage-Mortalität sowie dem Gesamtüberleben sowohl bei jüngeren als auch älteren Patienten führte. Diese Daten, haben zu einem Paradigmenwechsel geführt, der sich auch in der gerade aktualisierten DGHO-Onkopedia-Leitlinie widerspiegelt. Bei Patienten, die nicht aufgrund einer eingetretenen oder drohenden Komplikation (Leukostase, Blutung, Infektion) einer umgehende Therapieeinleitung bedürfen, ist es gerechtfertigt und ohne negativen prognostischen Effekt, zunächst die Diagnostik abzuwarten und erst dann die Therapie einzuleiten.
Fazit
Zusammengefasst haben die Beiträge der ASH-Tagung 2019 gezeigt, dass das bessere Verständnis der zugrunde liegenden Pathophysiologie zu einer zunehmend individualisierten Behandlung der AML-Patienten führt. Darüber hinaus führt die fortschreitende Aufklärung der Pathomechanismen zu innovativen Therapieansätzen und Kombinationstherapien, welche in einer Vielzahl von frühen und teilweise fortgeschrittenen Studienphasen getestet werden.
- Erstmals konnte ein Überlebensvorteil für eine Erhaltungstherapie mit CC-486 in der QUAZAR-AML-001-Studie nachgewiesen werden.
- Post-hoc-Analysen bringen neue Erkenntnisse bezüglich CPX-351 und Gilteritinib.
- Die Blockade der CD70-CD27-Achse durch den monoklonalen Antikörper Cusatuzumab stellt ein neues Wirkprinzip dar.
- Die Zeit zwischen der Diagnosestellung und dem Therapiebeginn hat keinen prognostischen Einfluss.
“Die Optionen zur Behandlung von AML-Patienten werden durch CC-486 erweitert und es ist auch in den kommenden Jahren mit therapeutischen Innovationen zu rechnen.” PD Dr. med. Thomas Schroeder
MDS
Update der MEDALIST-Studie bestätigt Wirksamkeit und Verträglichkeit von Luspatercept
Auf dem ASH-Kongress 2018 waren erstmals die Daten der randomisierten MEDALIST-Phase-III-Studie präsentiert worden. Diese hatten eine signifikante Reduktion der Transfusionsabhängigkeit und -frequenz bei anämischen Niedrigrisiko-MDS-Patienten (IPSS-R very low, low, intermediate) mit Ringsideroblasten und fehlendem oder verloren gegangenem Ansprechen, mit Intoleranz beziehungsweise einer geringen Chance auf ein Ansprechen auf Erythropoietin durch eine Behandlung mit Luspatercept, einem sogenannten TGF-b Ligand Trap, gezeigt (siehe auch Bericht vom ASH-Kongress 2018 auf hematooncology.com) [10]. Auf der diesjährigen ASH-Tagung wurde nun ein Update der Studie mit längerem Follow-up präsentiert [11]. Es zeigte sich, verglichen zu den Daten vom letzten ASH-Kongress, nun eine höhere Ansprechrate (47,1%, 2018: 37,9%) im Sinne des primären Endpunkts (Transfusionsfreiheit für Erythrozytenkonzentrate ³ 8 Wochen) infolge einer Behandlung mit Luspatercept im Gegensatz zu 15,8% für die Placebogruppe (2018: 13,2%). Darüber hinaus zeigte die Analyse, dass Patienten, die einmal diesen Endpunkt erreicht hatten, nach einem Verlust des Ansprechens durch eine Fortsetzung/Wiederaufnahme der Behandlung oftmals erneut ansprachen und transfusionsfrei wurden (48 Patienten = 66,7% ≥ 2 Ansprechperioden, 22 Patienten = 30,6% ≥ 3 Ansprechperioden). Die mediane Dauer einer Transfusionsfreiheit ≥ 8 Wochen innerhalb der ersten 48 Wochen betrug 30,6 Wochen (95-%-KI: 20,6–50,9) mit Luspatercept und 18,6 Wochen (95-%-KI: 10,9–nicht beurteilbar) mit Placebo. Die mediane Dauer eines klinischen Benefits (definiert als Transfusionsfreiheit von 8 Wochen oder Hematological Improvement-Erythroid [HI-E] gemäß den International-Working-Group-2006-Kriterien) durch eine Behandlung mit Luspatercept betrug 83,6 Wochen bezogen auf alle Patienten, die ansprachen.
Die längere Beobachtungszeit bestätigte auch die gute Verträglichkeit von Luspatercept. Es traten vornehmlich innerhalb der ersten 4 Zyklen Grad-1−2-Toxizitäten (Fatigue, Diarrhoe, Asthenie) auf, die meist im Verlauf verschwanden. Auch die Rate der Übergänge in eine AML war gering und vergleichbar mit der Placebogruppe (n = 3 [2,0%] vs. n = 1 [1,3%]). Zusammengefasst bestätigen die Daten der MEDALIST-Studie auch mit dem längeren Follow-up, dass Luspatercept eine gute Balance zwischen der Wirksamkeit und der Verträglichkeit aufweist und in dieser Patientengruppe nach der zu erwartenden Zulassung regelmäßig zum Einsatz kommen dürfte.
TP53-Mutation ist nicht gleich TP53-Mutation
Allgemein akzeptiert ist, dass eine Mutation im TP53-Gen bei MDS- und AML-Patienten mit einer Hochrisikokonstellation, einem komplexen Karyotyp, einer hohen Rate an AML-Transformationen sowie mit einer schlechten Prognose selbst nach einer allogenen Blutstammzelltransplantation einhergeht. Die Arbeitsgruppe von Elli Papaemmanuil hat unter dem Dach der International Working Group for the Prognosis of MDS (IWG-PM) untersucht, ob der Allelstatus, also die Frage, ob ein oder beide Allele des TP53-Gens betroffen sind, eine prognostische Rolle spielt [12]. Anhand einer Untersuchung von 380 Patienten mit einer TP53-Mutation konnte sie zeigen, dass etwa 2/3 der Patienten einen sogenannten „multi-hit“-Status aufweisen, das heißt, dass bei diesen Patienten beide Allele des TP53-Gens durch mehrere Mutationen, durch Deletionen oder durch einen „copy-neutral Loss of Heterozygosity“ (CN-LOH) betroffen waren. Patienten mit dieser „multi-hit“-Konstellation haben eine äußerst schlechte Prognose. Dagegen weisen Patienten, bei denen lediglich ein Allel des TP53-Gens betroffen ist (1/3 der Patienten), eine ähnliche Prognose auf wie Patienten, bei denen keine TP53-Mutation (Wildtyp-Konstellation) vorliegt. Diese Resultate, die an einer großen Vergleichskohorte bestätigt wurden, implizieren, dass die Betrachtung des TP53-Allelstatus in Zukunft bei der Diagnostik und Prognoseabschätzung zusätzlich berücksichtigt werden sollte.
APR-246 als Hoffnungsträger für TP53-mutierte MDS und AML?
Die oben geschilderte und in den meisten Fällen mit einer TP53-Mutation einhergehende schlechte Prognose wird weder durch die Standardbehandlung mit Azacitidin noch durch eine allogene Transplantation maßgeblich verbessert. Daher besteht insbesondere für diese Patientengruppe der Bedarf, die Behandlung zu verbessern.
Dieses Ziel hatten zwei parallel in Europa und den USA durchgeführte Phase-II-Studien, deren Daten nun präsentiert wurden. Diese hatten in einem einarmigen Design die Substanz APR-246, ein niedermolekularer P53-Reaktivator, in Kombination mit Azacitidin bei unbehandelten Patienten mit MDS und einer oligoblastischen AML mit einer TP53-Mutationen untersucht [13, 14]. TP53 fungiert physiologisch als Transkriptionsfaktor und induziert einen Zellzyklusarrest und eine Apoptose. TP53-Mutationen führen zum Funktionsverlust von TP53 und somit zum Überleben der malignen myeloischen Zellen. APR-246 stellt die Wildtypfunktion des mutierten TP53 im Sinne eines Tumorsuppressorgens wieder her und führt somit zum Zellzyklusarrest und zur Apoptose der malignen Zellen. Wie Tab. 1 zeigt, wurden in den beiden Phase-II-Studien insgesamt 108 Patienten mit APR-246 (Tag 1−4 i. v. über je 6 Stunden) in Kombination mit Azacitidin behandelt. Dabei zeigte sich in beiden Studien eine hohe CR-Rate und bei einem relevanten Anteil der Patienten sogar zytogenetische oder molekulare Remissionen. Beide Arbeitsgruppen berichteten von Neurotoxizität (Ataxie und kognitive Störungen) als substanzspezifische Nebenwirkung, welche jedoch rasch nach einer Unterbrechung der Therapie reversibel war und im Verlauf nicht erneut auftrat. Insgesamt sind die Daten in dieser Hochrisikogruppe vielversprechend und lassen auf positive Resultate der aktuell laufenden randomisierten Phase-III-Studie (NCT03745716) hoffen.

Tab. 1: Übersicht über mehrere auf dem ASH-Kongress präsentierte Phase-I/II-Studien zu neuen zielgerichteten Therapien bei MDS/AML ([13,14,15,16,17,18,19].
Weitere zielgerichtete Substanzen auch beim MDS auf dem Vormarsch
Neben dem oben genannten APR-246 werden auch beim MDS nun vermehrt „small molecules“ untersucht, welche bereits bei der AML ihren Nutzen bewiesen haben. So wurden 2 Phase-Ib-Studien vorgestellt, die den BCL2-Inhibitor Venetoclax bei Patienten mit MDS prüfen. Die erste Studie von Zeidan und Kollegen untersuchte Venetoclax als Monotherapie (n = 26) in einer Tagesdosis von 400 bis 800 mg oder in Kombination (n = 38) mit Azacitidin (7 x 75 mg/m2) in einer Tagesdosis von 100 bis 400 mg [15]. Es wurden insgesamt 64 MDS-Patienten eingeschlossen, die mit mindestens einer hypomethylierenden Substanz vorbehandelt waren und entweder refraktär hierauf waren oder ihr Ansprechen verloren hatten (Tab. 1)[15]. Während die Gesamtansprechrate infolge einer Venetoclax-Monotherapie mit 8% (8% CR im Knochenmark [mCR]) eher gering war, zeigte sich infolge der Kombinationstherapie eine Gesamtansprechrate von 40% (CR 32%, mCR 8%). Aufgrund dessen wird in Folgestudien die Kombinationstherapie in der Indikation weiterverfolgt. In der zweiten Studie wurde die Kombination von Venetoclax und Azacitidin (7 x 75 mg/m2) bei 57 therapienaiven Patienten mit fortgeschrittenem MDS (IPSS intermediate-2 oder high) untersucht (Tab. 1) [16]. Nachdem in der initialen Phase der Studie bei einer 28-tägigen Venetoclax-Applikation 2 von 12 Patienten infolge einer neutropenen Sepsis verstorben waren, wurde die Gabe auf 14 Tage limitiert. Dabei hat sich im weiteren Verlauf eine Phase-2-Dosis von 400 mg pro Tag herauskristallisiert. In der Erstlinienbehandlung zeigten sich sehr vielversprechende Ansprechraten, auch wenn die relativ geringe Fallzahl berücksichtigt werden muss. So betrug die Gesamtansprechrate 77,2% und die mCR- und CR-Rate jeweils 38,6%. Das Ansprechen hielt bei 83% der Patienten nach 12 Monaten noch an. 10 von 22 evaluierbaren Patienten (45%) zeigten sogar eine molekulare CR und lediglich 1,7% der Patienten waren primär progredient. Wie in der von Zeidan et al. präsentierten Studie waren auch in der Erstlinientherapie erwartungsgemäß Hämatotoxizität, febrile Neutropenie und Pneumonien die häufigsten Nebenwirkungen. Aussagekräftige Daten zum Gesamtüberleben sind aufgrund der relativ kurzen Nachbeobachtungszeit von 8,9 Monaten noch nicht verfügbar. Dennoch erscheint es sinnvoll, diesen Therapieansatz in der Primärtherapie analog zur AML auch beim fortgeschrittenen MDS weiterzuverfolgen.
Als weitere zielgerichtete Medikamente werden IDH-Inhibitoren auch bei Patienten mit MDS untersucht. Dabei wird der IDH1-Inhibitor Olutasidenib als Monotherapie und in Kombination mit Azacitidin bei Patienten mit MDS in einer Phase-I/II-Studie untersucht [20]. Der IDH2-Inhibitor Enasidenib, der in den USA bereits in der Monotherapie für die IDH2-mutierte AML zugelassen ist, wird aktuell in einer noch laufenden Phase-II-Studie getestet (Tab. 1) [17]. Dabei wird Enasidenib in Studienarm A in Kombination mit Azacitidin als Standardbehandlung bei HMA-naiven Hochrisiko-MDS-Patienten verabreicht, im Arm B jedoch als Monotherapie bei Patienten, die auf hypomethylierende Substanzen refraktär waren oder ihr Ansprechen verloren hatten. Insgesamt sind bisher 31 Patienten (Arm A: n = 13, Arm B: n = 18) in die Studie eingeschlossen worden. Die Gesamtansprechrate infolge der Kombinationsbehandlung bei den therapienaiven Patienten liegt bei 85% mit 77% CR/mCR und im Salvage-Arm bei 56% sowie 39% CR/mCR. Während das Nebenwirkungsprofil, wie erwartet, akzeptabel erscheint, sind aufschlussreiche Aussagen bezüglich des Überlebens noch nicht möglich. Bei 19% der Patienten trat ein für die IDH-Inhibitoren bekanntes Differenzierungssyndrom auf, welches jedoch mit den Standardmaßnahmen reversibel war.
Des Weiteren werden auch immunologische Therapieansätze bei Patienten mit MDS untersucht. Einen solchen stellt die Blockade des TIM-3-Moleküls durch den monoklonalen Anti-TIM-3-IgG4-Antikörper MBG453 dar. TIM-3 ist ein inhibitorischer Rezeptor auf zahlreichen Immunzellen und stellt somit einen relevanten Checkpoint des adaptiven und angeboren Immunsystems dar. Darüber hinaus wird TIM-3 auf myeloischen Progenitorzellen bei Patienten mit MDS und AML exprimiert, nicht jedoch auf gesunden Progenitorzellen. Dies macht TIM-3 zu einer interessanten Zielstruktur, mit der sowohl maligne Progenitorzellen direkt antikörpervermittelt als auch durch eine Wiederherstellung der immunologischen Kontrolle eliminiert werden können. Im Rahmen einer Phase-Ib-Studie wird diese Substanz aktuell in Kombination mit Decitabin und als Monotherapie bei 19 Patienten mit therapienaiven Hochrisiko-MDS, bei 22 Patienten mit neudiagnostizierter AML sowie bei 28 Patienten mit rezidivierter/refraktärer AML evaluiert (Tab. 1) [18]. Dabei zeigte vor allem die Kombinationstherapie vielversprechende Gesamtansprechraten von 58% (inklusive 47% CR/mCR) beziehungsweise 41% (inklusive 29% CR/CRi) bei unbehandelten Hochrisiko-MDS beziehungsweise neudiagnostizierten AML-Patienten. Die Verträglichkeit war gegeben und vergleichbar mit der einer Monotherapie mit Decitabin. Lediglich bei 5 (7%) von den insgesamt 69 behandelten Patienten trat ein immunvermitteltes Ereignis (jeweils Grad 3) auf. Die Kombination von Azacitidin oder Decitabin und MBG453 wird aktuell im Rahmen der internationalen STIMULUS-MDS1-Studie (NCT03946670) auch in deutschen Studienzentren bei Patienten mit unbehandeltem Hochrisiko-MDS geprüft [21].
Als weitere immunologische Zielstruktur wird das CD47-Molekül mittels des inhibitorischen Anti-CD47-Antikörpers Magrolimab therapeutisch adressiert. CD47 wird auf verschiedenen malignen Zellen und so auch auf AML- und MDS-Progenitoren exprimiert und verhindert durch die Bindung an das auf Makrophagen exprimierte SIRPa die Phagozytose durch die Makrophagen. Dieser Mechanismus wird auch als „Do not eat me“-Signal bezeichnet und die CD47-SIRPa-Achse stellt aufgrund dessen einen wichtigen Immuncheckpoint dar, der bei vielen Tumorarten aktuell als therapeutischer Angriffspunkt untersucht wird. Sallman et al. stellten nun eine Phase-Ib-Studie vor, in der Magrolimab (1,3 mg/kg wöchentlich) in Kombination mit Azacitidin in der Standarddosierung bei 27 unbehandelten AML-Patienten und bei 35 Hochrisiko-MDS-Patienten (IPSS-R intermediate, high, very high) überprüft wird (Tab. 1) [19]. Insgesamt ist die Substanz sehr gut verträglich. Es tritt allerdings als eine substanzspezifische Nebenwirkung zu Beginn passager oftmals ein Hb-Abfall auf, der aber durch eine Gabe einer Testdosis gemildert werden kann. Es zeigte sich bei 24 beziehungsweise bei 22 soweit auswertbaren MDS- und AML-Patienten ein vielversprechendes Wirksamkeitssignal: So betrug die Gesamtansprechrate 92% beziehungsweise 64% und die CR/CRi-Rate 83% beziehungsweise 60%. Die mediane Zeit bis zum Ansprechen lag bei 1,9 Monaten und die mediane Dauer des Ansprechens war bei einem noch kurzen Follow-up von 6,4 beziehungsweise 8,9 Monaten noch nicht erreicht. Die Studie rekrutiert aktuell noch in Expansionskohorten und wir dürfen auf die endgültigen Resultate gespannt sein.
Das molekulargenetische Profil und die Vorbehandlung bestimmen das Outcome nach allogener Transplantation bei Patienten mit MDS und sekundärer AML
2 Beiträge haben sich mit der Bedeutung von Genmutationen für das Outcome nach einer allogenen Blutstammzelltransplantation befasst. Dabei konnte die MD-Anderson-Gruppe anhand von 225 MDS-Patienten zeigen, dass insbesondere Mutationen im DNMT3A-Gen oder im RAS-Signalweg mit einem erhöhten Risiko für ein Rezidiv einhergehen [22]. TP53 hatte, wie in anderen Arbeiten bereits gezeigt, in der univariaten Analyse ebenfalls einen negativen prognostischen Einfluss. Allerdings erwies sich dies angesichts der großen Überlappung mit dem gleichzeitigen Vorliegen einer Hochrisikozytogenetik in der Multivariatanalyse nicht als signifikant. Die kombinierte Betrachtung des Mutationsstatus sowohl des DNMT3A-Gens als auch des RAS-Signalweges und des zytogenetischen Risikos nach IPSS hingegen ermöglichte eine bessere Risikostratifikation als die zytogenetische Information allein. Auch in unserer Analyse, bei der 128 Patienten untersucht worden waren, waren die beiden oben genannten Gene (NRAS und DNMT3A) prognostisch relevant und ermöglichten es, die Gruppe der Patienten mit einem komplexen Karyotyp hinsichtlich ihrer Prognose aufzuteilen. Zusätzlich waren in unserer Analyse die TP53-Mutation und die SF3B1-Mutation mit einer schlechteren Prognose vergesellschaftet, wobei wir im Gegensatz zur MD-Anderson-Gruppe auch einen negativen Einfluss auf das Gesamtüberleben zeigen konnten. Darüber hinaus konnten wir in unserer Analyse zeigen, dass die Art der Vorbehandlung vor der Transplantation (unbehandelt vs. Chemotherapie/Azacitidin) einen signifikanten Einfluss auf die Prognose der Patienten hat. Patienten, die direkt transplantiert wurden, hatten ein besseres Gesamtüberleben verglichen mit den Patienten, die vorbehandelt worden waren. Bei einer kombinierten Betrachtung des Mutationsstatus der 4 Poor-Risk-Mutationen (TP53, NRAS, DNMT3A und SF3B1) und der Vorbehandlung zeigte sich, dass Patienten, die eine solche Mutation tragen, nicht von einer Vorbehandlung profitieren und stattdessen eher direkt transplantiert werden sollten. Bei dieser Interpretation sollte allerdings die limitierte Fallzahl berücksichtigt werden, sodass es einer Validierung durch eine externe Kohorte bedarf, bevor eine abschließende Wertung vorgenommen werden kann.
Fazit
- Update der MEDALIST-Studie bestätigt die Effektivität und die Verträglichkeit des Luspatercept in der Anämiebehandlung bei Niedrigrisiko-MDS-Patienten.
- Luspatercept scheint bei individuellen Patienten auch wiederholt zu einem anhaltenden Ansprechen zu führen.
- Bei der Interpretation von TP53-Mutationen sollte zukünftig der Allelstatus zusätzlich berücksichtigt werden.
- Auch bei den MDS kommen vermehrt zielgerichtete, genotypische und teils neue immunologische Therapieansätze zum Einsatz und zeigen erste vielversprechende Resultate.
- Mutationen im Wechselspiel mit der Wahl der Vortherapie beeinflussen auch das Outcome nach einer allogenen Transplantation.
„Auch beim MDS setzt sich das bessere Verständnis der Pathophysiologie zunehmend in zielgerichtete Therapieansätze um.” PD Dr. med. Thomas Schroeder
Quellen
- Stone RM et al. Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3 Mutation. New England Journal of Medicine 2017; 377: 454-464.
- Wei AH et al. The QUAZAR AML-001 Maintenance Trial: Results of a Phase III International, Randomized, Double-Blind, Placebo-Controlled Study of CC-486 (Oral Formulation of Azacitidine) in Patients with Acute Myeloid Leukemia (AML) in First Remission. Blood 2019; 134: LBA-3.
- Rautenberg C et al. Relapse of Acute Myeloid Leukemia after Allogeneic Stem Cell Transplantation: Prevention, Detection, and Treatment. International journal of molecular sciences 2019; 20: 228.
- Lancet JE et al. CPX-351 (cytarabine and daunorubicin) Liposome for Injection Versus Conventional Cytarabine Plus Daunorubicin in Older Patients With Newly Diagnosed Secondary Acute Myeloid Leukemia. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2018; 36: 2684-2692.
- Lindsley RC et al. Genetic Characteristics and Outcomes By Mutation Status in a Phase 3 Study of CPX-351 Versus 7+3 in Older Adults with Newly Diagnosed, High-Risk/Secondary Acute Myeloid Leukemia (AML). Presented at Session 613: Acute Myeloid Leukemia: Clinical Studies, ASH 2019, Orlando, USA. Blood 2019; 134: 15-15.
- Perl AE et al. Gilteritinib or Chemotherapy for Relapsed or Refractory FLT3-Mutated AML. The New England journal of medicine 2019; 381: 1728-1740.
- Smith CC et al. Emerging Mutations at Relapse in Patients with FLT3-Mutated Relapsed/Refractory Acute Myeloid Leukemia Who Received Gilteritinib Therapy in the Phase 3 Admiral Trial. Blood 2019; 134: 14-14.
- Ochsenbein AF et al. Targeting CD70 with Cusatuzumab Eliminates Acute Myeloid Leukemia Stem Cells in Humans. Presented at Session 616: Acute Myeloid Leukemia: Novel Therapy, excluding Transplantation, ASH 2019, Orlando, USA. Blood 2019; 134: 234-234.
- Röllig C et al. Time from Diagnosis to Treatment Does Not Affect Outcome in Intensively Treated Patients with Newly Diagnosed Acute Myeloid Leukemia. Blood 2019; 134: 13-13.
- Fenaux P et al. The Medalist Trial: Results of a Phase 3, Randomized, Double-Blind, Placebo-Controlled Study of Luspatercept to Treat Anemia in Patients with Very Low-, Low-, or Intermediate-Risk Myelodysplastic Syndromes (MDS) with Ring Sideroblasts (RS) Who Require Red Blood Cell (RBC) Transfusions. Blood 2018; 132: 1-1.
- Fenaux P et al. Assessment of Longer-Term Efficacy and Safety in the Phase 3, Randomized, Double-Blind, Placebo-Controlled MEDALIST Trial of Luspatercept to Treat Anemia in Patients (Pts) with Revised International Prognostic Scoring System (IPSS-R) Very Low-, Low-, or Intermediate-Risk Myelodysplastic Syndromes (MDS) with Ring Sideroblasts (RS) Who Require Red Blood Cell (RBC) Transfusions. Blood 2019; 134: 841-841.
- Bernard E et al. TP53 State Dictates Genome Stability, Clinical Presentation and Outcomes in Myelodysplastic Syndromes. Blood 2019; 134: 675-675. https://ashpublications.org/blood/article-
- Cluzeau T et al. APR-246 Combined with Azacitidine (AZA) in TP53 Mutated Myelodysplastic Syndrome (MDS) and Acute Myeloid Leukemia (AML). a Phase 2 Study By the Groupe Francophone Des Myélodysplasies (GFM). Blood 2019; 134: 677-677.
- Sallman DA et al. Phase 2 Results of APR-246 and Azacitidine (AZA) in Patients with TP53 mutant Myelodysplastic Syndromes (MDS) and Oligoblastic Acute Myeloid Leukemia (AML). Blood 2019; 134: 676-676.
- Zeidan AM et al. A Phase 1b Study Evaluating the Safety and Efficacy of Venetoclax As Monotherapy or in Combination with Azacitidine for the Treatment of Relapsed/Refractory Myelodysplastic Syndrome. Presented at Session 637: Myelodysplastic Syndromes-Clinical Studies, ASH 2019, Orlando, USA. Blood 2019; 134: 565-565.
- Wei AH et al. A Phase 1b Study Evaluating the Safety and Efficacy of Venetoclax in Combination with Azacitidine in Treatment-Naïve Patients with Higher-Risk Myelodysplastic Syndrome. Presented at Session 637: Myelodysplastic Syndromes-Clinical Studies, ASH 2019, Orlando, USA. Blood 2019; 134: 568-568.
- Richard-Carpentier G et al. Preliminary Results from the Phase II Study of the IDH2-Inhibitor Enasidenib in Patients with High-Risk IDH2-Mutated Myelodysplastic Syndromes (MDS). Presented at Session 637: Myelodysplastic Syndromes-Clinical Studies, ASH 2019, Orlando, USA. . Blood 2019; 134: 678-678.
- Borate U et al. Phase Ib Study of the Anti-TIM-3 Antibody MBG453 in Combination with Decitabine in Patients with High-Risk Myelodysplastic Syndrome (MDS) and Acute Myeloid Leukemia (AML). Presented at Session 637: Myelodysplastic Syndromes-Clinical Studies, ASH 2019, Orlando, USA. . Blood 2019; 134: 570-570.
- Sallman DA et al. The First-in-Class Anti-CD47 Antibody Magrolimab (5F9) in Combination with Azacitidine Is Effective in MDS and AML Patients: Ongoing Phase 1b Results. Presented at Session 637: Myelodysplastic Syndromes-Clinical Studies, ASH 2019, Orlando, USA. . Blood 2019; 134: 569-569.
- Cortes JE et al. Olutasidenib (FT-2102) Induces Rapid Remissions in Patients with IDH1-Mutant Myelodysplastic Syndrome: Results of Phase 1/2 Single Agent Treatment and Combination with Azacitidine. Blood 2019; 134: 674-674.
- Zeidan AM et al. A Randomized, Double-Blind, Placebo-Controlled, Phase II Study of MBG453 Added to Hypomethylating Agents (HMAs) in Patients (pts) with Intermediate, High, or Very High Risk Myelodysplastic Syndrome (MDS): Stimulus-MDS1. Blood 2019; 134: 4259-4259.
- Yalniz FF et al. Somatic Mutations Improve Risk Classification By Cytogenetic Abnormalities in Patients with Myelodysplastic Syndrome after Hematopoietic Stem Cell Transplantation. Blood 2019; 134: 512-512.
- „Orlando, Florida. Lake Eola and palm trees in foreground.”: © Laura Stone/Adobe Stock
Indolente und aggressive Lymphome 2019 – Neues aus Orlando
Prof. Dr. med. Dimitrios Mougiakakos, Klinik für Innere Medizin 5, Hämatologie und Internistische Onkologie, Universitätsklinikum Erlangen
 Auf der ASH-Jahrestagung, dem weltgrößten Kongress für Hämatoonkologen, die in diesem Jahr in Orlando stattfand, wurden wieder mal viele spannende präklinische und klinische Ansätze für die Behandlung von Lymphomen präsentiert.
Auf der ASH-Jahrestagung, dem weltgrößten Kongress für Hämatoonkologen, die in diesem Jahr in Orlando stattfand, wurden wieder mal viele spannende präklinische und klinische Ansätze für die Behandlung von Lymphomen präsentiert.
Die Daten zu den CAR-T-Zellen sind nunmehr reifer und es werden nicht nur neue Einsatzfelder (wie das Mantelzelllymphom) erschlossen, sondern wir bekommen auch ein besseres Bild bezüglich der Nebenwirkungen und neuer prädiktiver Biomarker. Darüber hinaus wurden interessante Kombinationen nichtzytostatischer Therapeutika untersucht und ein bispezifischer Antikörper zeigte Wirksamkeit nach einem CAR-T-Zell-Versagen. Auch wurde die Frage nach einer Erhaltungstherapie beim Morbus Waldenström in einer Studie sehr überzeugend adressiert, sodass wir mit vielen neuen Einsichten die Heimreise antreten konnten.
Indolente Lymphome
Das follikuläre Lymphom (FL) ist mit einem Anteil von 25% die häufigste indolente Lymphomvariante. In der Regel beträgt das mediane Überleben 15 bis 20 Jahre. Bei einem Krankheitsrückfall bestehen in der Regel gute Therapiemöglichkeiten.
In einer Arbeit der italienischen Studiengruppe um Pulsoni [1] ist man der Frage nachgegangen, ob man die Behandlung des lokalisierten FL unter Berücksichtigung der minimalen Resterkrankung (MRD) steuern kann. Im Stadium I/II erfolgt in der Regel eine Bestrahlung der beteiligten Lymphknoten. In dieser prospektiven, multizentrischen Phase-II-Studie wurde bei einer lokalisierten Erkrankung eine MRD-Bestimmung aus dem peripheren Blut und dem Knochenmark durchgeführt. Nach einer Radiotherapie mit 24 Gy wurde die MRD erneut bestimmt. Bei einer Positivität schloss sich eine Anti-CD20-Antikörpertherapie mit Ofatumumab (für insgesamt 8 Zyklen) an. Nach 6 Monaten wurde die MRD-Kontrolle bei allen Patienten wiederholt. Eingeschlossen waren insgesamt 106 Patienten, davon waren 32 MRD-positiv. Von diesen Patienten waren nach der Radiatio 18 Patienten weiterhin MRD-positiv. Es konnte damit also eine Reduktion um 52% erreicht werden. Von den initial 73 MRD-negativen Patienten waren im Verlauf 7 von ihnen MRD-positiv. Insgesamt qualifizierten sich damit 25 Patienten für eine Antikörpertherapie. Sie erreichten eine Konversion zu einer MRD-Negativität von 87% im Knochenmark und von 90% im peripheren Blut. Diese Daten spiegelten sich auch in einem 24-monatigen progressionsfreien Überleben (PFS) von 83% und in einem 24-monatigen Gesamtüberleben (OS) von 99% wider (Abb. 1).
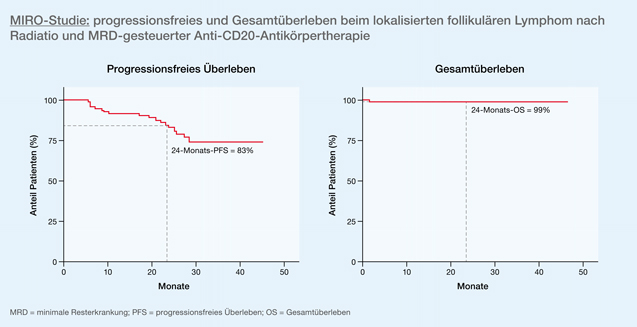
Abb. 1: MIRO-Studie: 24-Monats-PFS (83%) und 24-Monats-OS (99%) beim lokalisierten follikulären Lymphom nach einer Radiatio und einer MRD-gesteuerten Anti-CD20-Antikörpertherapie (modifiziert nach [1]).
Erste zielgerichtete zytostatikafreie Therapien werden als wirksame und verträgliche Option im refraktären/rezidivierten Setting etabliert. Darunter fällt das R2-Regime (Lenalidomid in Kombination mit Rituximab), das vom Committee for Medicinal Products for Human Use (CHMP) im November 2019 eine Zulassungsempfehlung zur Behandlung erwachsener Patienten mit vorbehandeltem follikulärem Lymphom (Grad 1-3a) erhalten hat. Die Grundlage dafür ist die Phase-III-Studie AUGMENT (NCT01938001) [2], zu der eine Subgruppenanalyse auf dem ASH-Kongress 2019 präsentiert wurde. Diese bestätigte die Wirksamkeit und die Verträglichkeit von R2 bei ≥ 70-jährigen Patienten mit indolentem Non-Hodgkin-Lymphom (iNHL) [3].
In einer laufenden Phase-Ib/II-Studie (NCT02600897) wurde eine neue Dreifachkombination für das refraktäre/rezidivierte follikuläre Lymphom (R/R FL) evaluiert [4]. Das Studiendesign sah eine Induktion für insgesamt 6 Zyklen mit dem Anti-CD79b-Immunotoxin Polatuzumab Vedotin, mit Lenalidomid und mit dem Anti-CD20-Antikörper Obinutuzumab vor. Im Anschluss folgte eine Erhaltungstherapie mit Obinutuzumab zweimonatlich für insgesamt 24 Monate und mit Lenalidomid für 12 Monate. Eingeschlossen wurden Patienten mit einem R/R FL (Grad 1–3a). Das Studienkollektiv umfasste 56 Patienten mit im Median 3 Vortherapien, wobei fast 60% refraktär gegenüber ihrer letzten Behandlung waren. In 84% der Fälle wurden Grad 3–4 Toxizitäten beobachtet, wobei der Großteil der Hämatotoxizität zuzuordnen war und die Hälfte der Patienten in der Induktion den Granulozyten-Kolonie-stimulierenden Faktor (G-CSF) benötigt hat. Eine periphere Neuropathie, die eine gut dokumentierte Nebenwirkung von Polatuzumab war, konnte bei 30% der Patienten nachgewiesen werden, wobei Grad 2 nicht überschritten wurde. Das Gesamtansprechen (OR) lag bei 83% mit 61% kompletten Remission (CR). Auch Patienten, die zuvor resistent waren und/oder relativ schnell nach der letzten Therapie wieder progredient waren, zeigten ein Ansprechen (Abb. 2). Dies ist am ehesten auf die unterschiedlichen Wirkmechanismen zurückzuführen. Insgesamt verblieben 83% der Patienten nach 12 Monaten progressionsfrei. Für eine bessere Einschätzung ist jedoch eine längere Nachbeobachtungszeit nötig.
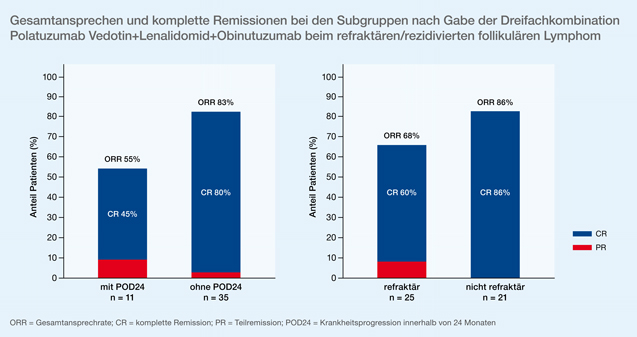
Abb. 2: Gesamtansprechen und komplette Remissionen in den Untergruppen mit/ohne POD24 beziehungsweise mit/ohne Refraktärität gegenüber der letzten Therapie: Trotz Progredienz zeigte sich ein Ansprechen auf Polatuzumab Vedotin, Lenalidomid und Obinutuzumab (modifiziert nach [4]).
In einer Arbeit, die den m7-Follicular-Lymphoma-International-Prognostic-Index-Score, kurz: m7-FLIPI-Score [5], innerhalb der verschiedenen Behandlungsgruppen der GALLIUM-Studie (NCT01332968) getestet hat [6], konnte zunächst gezeigt werden, dass dieser prädiktiv für die Obinutuzumab(G)-/Rituximab(R)-CHOP(Cyclophosphamid+Doxorubicin oder Adriamycin+Vincristin+ Predniso(lo)n)- beziehungsweise G-/R-CVP(Cyclophosphamid+Vincristin+Prednisolon)-Kohorten ist. Dieses Potenzial büßt er jedoch bei der Therapie mit G-/R-Bendamustin ein. Im weiteren Verlauf konnte herausgearbeitet werden, dass der Mutationsstatus von EZH2 die Empfindlichkeit gegenüber den verschiedenen chemoimmuntherapeutischen Protokollen determinieren könnte.
Bei den FL haben 20% der Patienten eine Mutation im EZH2-Gen (EZH2 mut). Zudem könnte man aus den präsentierten Daten ableiten, dass in der mutierten Situation ein CHOP-basiertes Protokoll von Vorteil wäre, wohingegen bei einem Vorliegen des Wildtyps (EZH2 wt) Bendamustin präferiert werden sollte (Abb. 3).
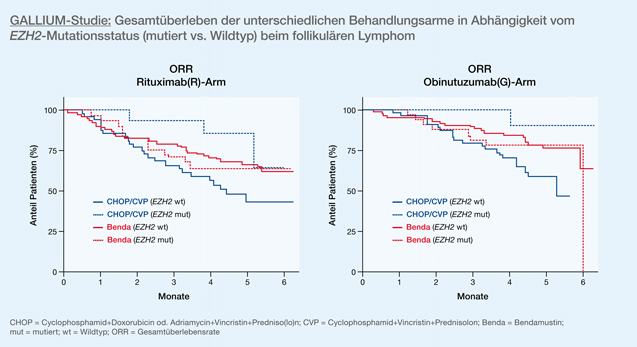
Abb. 3: GALLIUM-Studie: Überlebenskurven bei R-CHOP/CVP, R-Bendamustin gegenüber G-CHOP/CVP und G-Bendamustin, abhängig vom EZH2-Mutationsstatus (modifiziert nach [6]).
Im Kontext mit EZH2-Mutationen wurde zudem eine multizentrische, offene Phase-II-Studie bei R/R FL vorgestellt [7]. Es wurde dabei die Wirksamkeit und Sicherheit von Tazemetostat, einem selektiven, oralen EZH2(Enhancer von Zeste Homolog 2)-Inhibitor, als Monotherapie untersucht. Sie konnte vor allem im EZH2-mut-Kollektiv mit einer Gesamtansprechrate (ORR) von 78% (davon aber 9% CR) und einem medianen PFS von 13,8 Monaten eine Wirksamkeit nachweisen. Die Nebenwirkungen waren dabei überschaubar, sodass dieser Ansatz in der Zukunft noch weiterverfolgt werden sollte.
Beim seltenen Morbus Waldenström, der ebenfalls zu der Gruppe der indolenten Lymphome gehört, stehen wir regelmäßig vor der Frage, ob wir eine Erhaltungstherapie mit Rituximab analog zum FL durchführen sollen. Diesem offenen Punkt ist man in der multizentrischen Phase-III-Studie StiL NHL7-2008 MAINTAIN (NCT00877214) nachgegangen [8]. Es wurden dazu 218 Patienten nach einer Behandlung mit R-Bendamustin in 2 gleich große Arme randomisiert: ohne Erhaltungstherapie versus 2 Jahre Therapie mit Rituximab alle 2 Monate. Tatsächlich zeigte sich bei einer medianen Beobachtungszeit von 80 Monaten kein Unterschied.
Fazit
- Eine Antikörpertherapie könnte in bestimmten Krankheitssituationen bei FL-Stadium I/II eine sinnvolle Ergänzung zur lokalen Radiatio darstellen.
- Zielgerichtete, zytostatikafreie Therapien könnten in der refraktären/rezidivierten Situation eine wirksame und verträgliche Option sein.
- Für Patienten mit Morbus Waldenström kann eine Rituximab-Erhaltungstherapie nicht generell nach einer Chemoimmuntherapie empfohlen werden.
“Chemotherapiefreie Konzepte rücken immer mehr in den Fokus der Behandlung von rezidivierten oder refraktären follikulären Lymphomen. Es bleibt spannend, ob sie den Weg in noch frühere Therapielinien finden werden.” Prof. Dr. med. Dimitrios Mougiakakos
Aggressive Lymphome
Von den neu diagnostizierten Lymphomen gehören ungefähr 40% zu den aggressiven Varianten. Die Heilungsrate unter dem Einsatz einer sehr effektiven konventionellen Immunchemotherapie in der Erstlinie liegt bei circa 60 bis 70%. Patienten mit einem Rezidiv oder einem Nichtansprechen (R/R) nach einer Erstlinienbehandlung weisen jedoch eine ungünstige Prognose auf.
Für diese Patientengruppe sind bereits zelluläre Therapien (wie unten näher beschrieben) zugelassen. In der vorgestellten Arbeit von Stephen J. Schuster et al. [9] wird eine Strategie mit bispezifischen Antikörpern verfolgt. Mosunetuzumab (RG7828; BTCT4465A) ist ein vollständig humanisierter IgG1-Antikörper mit einer Spezifität gegen CD3 (auf T-Zellen) und gegen CD20 (auf Lymphomzellen) [10]. Damit wird über diesen „off-the-shelf“-Ansatz ein „Rendezvous“ zwischen der malignen Zelle und dem aktivierten Lymphozyten vermittelt.
Die primären Endpunkte der GO29781-Studie (NCT02500407) waren die Sicherheit und die Effizienz. Eingeschlossen wurden Patienten mit einem refraktären/rezidivierten B-Zell-Non-Hodgkin-Lymphom (R/R B-Zell-NHL) mit mindestens ≥ 1 Vortherapie. Initial wurden 8 Behandlungszyklen durchgeführt. Beim Erreichen einer CR wurde die Therapie beendet. Kam es nur zu einer partiellen Remission (PR) oder zu einer Stabilisierung der Erkrankung (SD) wurde die Therapie für bis zu 17 Zyklen fortgeführt. Eine Reexposition von Patienten, die nach zuvor erreichter CR rezidivierten, war ebenfalls erlaubt. Die Dosisfindung ist zurzeit noch nicht abgeschlossen.
Es wurden insgesamt 270 Patienten behandelt. Davon hatten 2/3 aggressive Lymphome. 30 Patienten hatten bereits eine Behandlung mit CAR-T-Zellen (T-Zellen mit einem chimären Antigenrezeptor) erhalten. Das mediane Alter lag bei 62 Jahren und die Zahl systemischer Vortherapien bei 3 (1–14). 72% waren refraktär gegenüber der letzten Behandlung.
Behandlungsabbrüche aufgrund der Toxizität waren mit 5,5% selten. Ein Zytokinfreisetzungssyndrom (CRS) wurde bei 78 Patienten beobachtet, wobei der Großteil davon als Grad 1 eingestuft wurde. Die meisten CRSs traten beim ersten Zyklus auf. Eine neurologische Toxizität, die sich hauptsächlich in Form von Kopfschmerzen, Schlaflosigkeit und Schwindel bemerkbar machte, wurde bei 43,7% der Patienten beobachtet.
Indolente B-NHLs zeigten ein ORR von 62,7% (davon 43,3% CR). In der Gruppe der aggressiven Lymphome lag die ORR bei 37,1% mit einer CR-Rate von 19,4%. Von den Patienten mit CR waren zum Zeitpunkt bis zu 26 beziehungsweise 16 Monaten nach dem Ende der Behandlung jeweils 82,8% und 70,8% ohne Progress.
Ein weitverbreitetes chemoimmuntherapeutisches Schema in der refraktären/rezidivierten Situation ist die Kombination von Gemcitabin, Oxaliplatin und optional Rituximab (GemOx bzw. R-GemOx). Bisher liegen aber nur wenige systematisch zusammengetragene Beobachtungsdaten dazu vor. In einer Arbeit vom Memorial Sloan Kettering Center aus New York wurden bis Januar 2018 in einem Zeitraum von 11 Jahren insgesamt 140 Fälle erfasst [11]. Der Großteil der Patienten hatte ein diffus großzelliges B-Zell-Lymphom (DLBCL) oder ein transformiertes aggressives Lymphom. Primär refraktär waren 40% der Patienten, im Rezidiv waren 60%. Das mediane PFS lag bei 1,4 Monaten und das OS bei nur 7,8 Monaten. Rituximab hatte dabei keinen Einfluss auf das PFS.
In einer weiteren Phase-II-Studie wurde eine Dreifachkombination frei von Zytostatika evaluiert: Rituximab, Lenalidomid und Ibrutinib [12]. Erste Erfahrungen zu dieser Kombination gibt es bereits für das follikuläre Lymphom [13], ohne dass Hinweise auf eine sich verstärkende Toxizität vorliegen. In die Studie wurden 89 Patienten mit einem R/R Non-GCB(Germinal Center B-Cell-like)-DLBCL eingeschlossen, die nicht für eine Stammzelltransplantation nach einer Hochdosistherapie infrage kamen. Darüber hinaus sollte in der Immunhistochemie gemäß dem sogenannten Hans-Algorithmus (einer Kombination aus CD10, BCL-6 und MUM1) ein DLBCL vom Nichtkeimzentrumstyp (Non-GCB) vorliegen, da es dazu bereits Hinweise für eine besondere Wirksamkeit von Therapien, die auf immunmodulatorischen Substanzen (IMiDs) oder einem Bruton-Tyrosinkinaseinhibitor (BTKi) basieren, gab [14].
Im Rahmen des iR2-Regimes wurden Lenalidomid (20 oder 25 mg p. o., an den Tagen 1 bis 21 eines 28-Tagezyklus), Ibrutinib (560 mg p. o. täglich) und Rituximab (375 mg/m2 i. v., an Tag 1 im Zyklus 1 bis 6) verabreicht. Die Therapie wurde fortgesetzt bis zum Progress oder einer nicht tolerablen Toxizität. Das mediane Alter betrug 64 Jahre. Die Patienten hatten im Median 2 (1–5) Vortherapien erhalten und in 63% der Fälle eine Stadium-IV-Erkrankung nach der Ann-Arbor-Klassifikation. Die refraktären und rezidivierten Erkrankungen waren etwa gleich stark repräsentiert.
Die Therapiedauer betrug im Median 16 Monate, und es dauerte 2,7 Monate bis zu einem initialen Ansprechen. Das Gesamtansprechen betrug 47% mit einer CR-Rate von 28% und einer Teilremissions(PR)-Rate von 19%. Das mediane PFS lag bei 5,0 Monaten, das mediane OS bei 9,5 Monaten. Die häufigste Grad-3/4-Toxizität war die Neutropenie, 18% der Patienten entwickelten ein makulopapulöses Exanthem. Bei 17% der Patienten konnte die Therapie aufgrund der Nebenwirkungen nicht fortgeführt werden.
Fazit
- Der bispezifische Antikörper Mosunetuzumab ist eine interessante Substanz. Die CR-Raten beim aggressiven Lymphom liegen bei < 20% und könnten im Verlauf der endgültigen Dosisfindung gegebenenfalls noch weiter verbessert werden.
- R-GemOx ist eine breit eingesetzte Substanzkombination beim R/R B-NHL. Die Effektivität ist jedoch nicht zufriedenstellend, sodass weiterhin ein Bedarf an neuen Therapieoptionen besteht.
- Die Ergebnisse zum iR2-Regime in einer schwer zu behandelnden Subgruppe sind hinsichtlich der Wirksamkeit und des Sicherheitsprofils vielversprechend. Es müssen jedoch noch weitere Datenanalysen im Verlauf durchgeführt werden.
“Ein weiteres Mal bleibt R-CHOP der Standard in der Erstlinientherapie von aggressiven Lymphomen. Im Bereich der R/R-Situation erscheinen außerhalb des CAR-T-Zell-Ansatzes bispezifische Antikörper vielversprechend.” Prof. Dr. med. Dimitrios Mougiakakos
CAR-T-Zell-Therapien
Patienten mit einem rezidivierten/refraktären Mantelzelllymphom (R/R MCL), die bereits mit einem BTKi behandelt worden sind, haben ein medianes Gesamtüberleben von knapp unter 6 Monaten [15]. Für einen Bruchteil der betroffenen Patienten kommt eine Stammzelltransplantation vom Fremdspender (allo HSZT) infrage. In der vorgestellten Phase-II-Studie ZUMA-2 (NCT02601313) wurden Patienten in dieser Konstellation mit KTE-X19, einem Anti-CD19-CAR-T-Zell-Präparat der 2. Generation mit der kostimulatorischen Domäne 4-1BB, behandelt [16]. Zudem wurden zirkulierende MCL-Zellen aus dem Apheresat während der CAR-T-Zell-Produktion entfernt [17]. In die Zuma-2-Studie wurden Patienten mit R/R MCL eingeschlossen. Die Vortherapie sollte eine anthrazyklin- oder bendamustinhaltige Chemotherapie, einen Anti-CD20-Antikörper und einen BTKi enthalten haben. Die Ausschlusskriterien umfassten unter anderem eine vorangegangene allo HSZT sowie eine ZNS-Beteiligung. Die angestrebte Zieldosis betrug 2 x 106 CAR-T-Zellen/kg Körpergewicht und wurde nach einer Lymphodepletion mit 30 mg/m2/d Fludarabin und 500 mg/m2/d Cyclophosphamid an 3 konsekutiven Tagen verabreicht. Der primäre Endpunkt der Studie war das Gesamtansprechen (ORR = CR + PR) gemäß den Lugano-Kriterien.
KTE-X19 konnte für 69 Patienten hergestellt werden und wurde 68 davon appliziert. Die mediane Produktionszeit betrug 16 Tage. Die mediane Zahl an Vortherapien belief sich auf 3. 69% der Patienten waren zuvor BTKi-resistent. Eine überbrückende Therapie mit Steroiden oder BTKi war möglich und lag im Ermessen des Behandlers. Insgesamt haben 25 Patienten eine solche erhalten. Diese interponierte Behandlung hatte (wenn überhaupt) nur eine stabilisierende Wirkung, da die mittels PET-CT untersuchten Patienten überwiegend eine zunehmende Krankheitsaktivität aufgewiesen haben.
Das Gesamtansprechen lag bei 93%. Die mediane Zeit bis zum Ansprechen lag bei einem Monat. Eine CR konnte in 67% der Fälle erreicht werden. Darüber hinaus wurde bei 40% der Patienten eine konsekutive Konversion von SD oder partieller PR zu einer CR beobachtet. Nach 12,3 Monaten verblieben 57% der Patienten in Remission. Von den ersten 28 behandelten Patienten (mit einer medianen Beobachtungszeit von nunmehr 27 Monaten) waren weiterhin 43% in Remission, ohne eine zusätzliche Therapie erhalten zu haben. Das geschätzte 12-Monats-PFS lag bei 61%, das geschätzte 12-Monats-OS bei 83%. Die Mediane wurden jeweils nicht erreicht (Abb. 4).
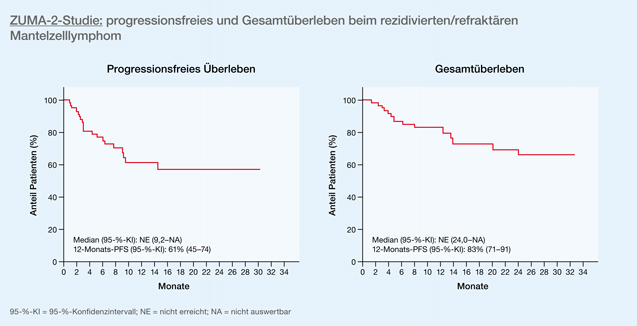
Abb. 4. ZUMA-2-Studie: progressionsfreies Überleben und Gesamtüberleben beim R/R MCL unter Therapie mit der Anti-CD19-CAR-T-Zell-Produkt KTE-X19 (modifiziert nach [16]).
Die häufigsten ≥ Grad-3-Nebenwirkungen waren vor allem hämatotoxischer Natur. 62 Patienten entwickelten ein CRS. Von ihnen hatten 40 eine gegen den Interleukin-6(IL-6)-Rezeptor gerichtete Therapie mit Tocilizumab und 15 Steroide im Verlauf benötigt. Ein Grad-5-CRS trat bei keinem Patienten auf. Neurotoxizität konnte bei 43 Patienten festgestellt werden. Sie erreichte bei 21 Patienten einen Schweregrad 3. Ein einzelner Patient bot das Bild einer Grad-4-Neurotoxizität, die nach Behandlungsversuchen mit IL-6-Blockade, Hochdosissteroiden und einer intrathekalen Chemotherapie schließlich mit Antithymozytenglobulin (ATG) erfolgreich therapiert wurde. Die stärkste Expansion der CAR-T-Zellen fand um den Tag 15 statt und korrelierte quantitativ mit dem Ansprechen.
Patienten mit einem DLBCL, die nicht auf eine Zweitlinientherapie ansprechen, sind zu < 50% responsiv gegenüber einer weiteren Behandlung [18]. Konventionelle Interventionen führen bei chemorefraktären Erkrankungen zu CR-Raten von 7% mit einem medianen OS von 6 Monaten [19]. Bereits zugelassene CAR-T-Zell-Produkte, die gegen CD19 gerichtet sind, zeigen hohe und teilweise anhaltende Ansprechraten [20, 21].
Das Präparat Lisocabtagene Maraleucel (liso-cel; JCAR017) ist ebenfalls gegen CD19 gerichtet und hat die kostimulatorische Signaldomäne 4-1BB. Es unterscheidet sich von den bereits verfügbaren Präparaten unter anderem darin, dass die CD4+- und CD8+-CAR-T-Zellen separat hergestellt und in einem definierten Verhältnis reappliziert werden. Dadurch erhofft man sich eine geringere Inzidenz von CRS und Neurotoxizität. In der auf dem ASH-Kongress 2019 vorgestellten Studie TRANSCEND NHL 001 (NCT02631044) [22] wurden Patienten mit einem R/R DLBCL (inklusive transformierter Lymphome, primär mediastinaler B-NHLs und follikulärer Lymphome Grad 3B) nach mindestens ≥ 2 Vortherapien eingeschlossen. Eine vorherige autologe und allogene Stammzelltransplantation sowie eine ZNS-Beteiligung waren dabei kein Ausschlusskriterium. Insgesamt wurden in dieser Studie 269 Patienten mit einem Zellpräparat behandelt, welches die vorgegebenen Spezifikationen erfüllte. Von diesen Patienten wiesen 89% Hochrisikomerkmale auf.
Ähnlich wie bei vergleichbaren CAR-T-Zell-Studien war der Großteil der ≥ Grad-3-Toxizitäten, die 79% der Patienten betroffen hatten, im Bereich der (teilweise prolongierten) Myelosuppression angesiedelt. Im Hinblick auf ein CRS und eine Neurotoxizität ≥ Grad 3 betrug der Anteil jeweils 2% und 10% und war damit vergleichsweise niedrig. Die ORR betrug 73% und in 53% der Fälle wurde eine CR erreicht. Die mediane Dauer bis zum Ansprechen betrug einen Monat. Das 12-Monats-PFS belief sich auf 44,1%, das entsprechende OS lag bei 57,9%. CAR-T-Zellen konnten nach 12 Monaten bei 53% der untersuchten Patienten nachgewiesen werden. Die Kinetik der CD4+- und CD8+-CAR-T-Zell-Expansion verhielt sich kongruent.
Zusätzlich zu diesen größeren und weiter fortgeschrittenen Studien wurden sehr interessante Aspekte zu Fragen der CAR-T-Zell-Therapie in verschiedenen Beiträgen adressiert. Eine der häufigsten Nebenwirkungen ist das CRS, welches durch eine Blockade des IL-6-Signalweges und eine Steroidgabe behandelt wird. Steroide stehen jedoch im Verdacht, die Funktion und die Expansion der CAR-T-Zellen negativ zu beeinflussen. Dieser Frage ist man in 2 Studien mit jeweils einem Kollektiv von R/R-ALL(akute lymphatische Leukämie)-Patienten [23] und R/R-DLBCL-Patienten [24], die mit CAR-T-Zellen behandelt worden waren, nachgegangen. Tatsächlich konnte in beiden Arbeiten gezeigt werden, dass der frühzeitige Einsatz von Steroiden keinen negativen Einfluss auf die Expansion von CAR-T-Zellen oder dem Therapieansprechen hatte.
In einer Reihe von Biomarker-Studien wurden neue Faktoren exploriert, die das Therapieansprechen (ko-)determinieren könnten. In einer Studie aus dem ZUMA-1-Kollektiv zur Wirksamkeit von CD19-CAR-T-Zellen heraus wurde die prädiktive Potenz zirkulierender Lymphom-DNA (ctDNA) untersucht [25]. Ein Nachweis von ctDNA am Tag 28 nach einer CAR-T-Zell-Applikation war tatsächlich mit einem kürzeren PFS und OS vergesellschaftet. Dabei war die prädiktive Sensitivität vergleichbar mit einer PET-CT bei einer etwas höheren Spezifität. Interessanterweise konnte ctDNA vor einem bildmorphologischen Rezidiv detektiert werden. Aus der TRANSCEND-NHL-001-Studie heraus wurde die Rolle der Immuninfiltration des Lymphommikromilieus (TME) vor und nach einer CAR-T-Zell-Therapie untersucht [22]. Aktivierte T-Zellen im TME waren dabei prädiktiv für ein initiales Ansprechen auf CAR-T-Zellen. Zudem war die Infiltration des TME durch CAR-T-Zellen und durch endogene (vor allem CD4+-T-Zellen) entscheidend für eine dauerhafte Wirksamkeit der Therapie, was nochmals die Bedeutung der Rekrutierung unterstreicht. Diese Arbeit hebt hervor, wie wichtig es in der Zukunft sein wird, die immunologische Fitness vor (ggf. über den Einsatz von BTKi oder IMiDs) und nach einer CAR-T-Zell-Gabe zu unterstützen.
Fazit
- Die ZUMA-2-Studie ist die erste multizentrische Phase-II-CAR-T-Zell-Studie für Patienten mit einem R/R MCL. Die Wirksamkeit und das Toxizitätsprofil sind in einer Situation vielversprechend, in der die bisherigen Behandlungsoptionen limitiert sind.
- Die Studie TRANSCEND NHL 001 ist die bisher größte Untersuchung, die Anti-CD19-CAR-T-Zellen beim aggressiven Lymphom untersucht. Die gute Wirksamkeit und die niedrigen Raten an CRS und Neurotoxizität sind vielversprechend und könnten möglicherweise eine ambulante Behandlung erlauben.
- Der frühzeitige Einsatz von Steroiden scheint die Effektivität von CAR-T-Zell-basierten Therapien beim Vorliegen einer ALL oder einem DLBCL nicht negativ zu beeinflussen.
“Die CAR-T-Zell-Therapie ist mittlerweile in der Behandlung der Lymphome angekommen. Dabei nimmt sowohl die Zahl von untersuchten Indikationen als auch die Zahl der (technischen) Optimierungen zu. In den kommenden Jahren ist mit weiteren Zulassungen aus diesem Bereich zu rechnen.” Prof. Dr. med. Dimitrios Mougiakakos
Quellen
- Pulsoni A et al. EARLY STAGE Follicular Lymphoma: First Results of the FIL “Miro” Study, a Multicenter Phase II Trial Combining Local Radiotherapy and MRD-Driven Immunotherapy. Presented at Session: 623. Mantle Cell, Follicular, and Other Indolent B-Cell Lymphoma—Clinical Studies: Follicular Lymphoma: Biomarkers and Clinical Trials. ASH 2019, Orlando, abstract 124.
- Leonard JP et al. AUGMENT: A Phase III Study of Lenalidomide Plus Rituximab Versus Placebo Plus Rituximab in Relapsed or Refractory Indolent Lymphoma. J Clin Oncol 2019; 37: 1188-1199.
- Trněný M et al. Subgroup Analyses of Elderly Patients Aged ≥ 70 Years in AUGMENT: A Phase III Randomized Study of Lenalidomide Plus Rituximab (R2) vs Rituximab Plus Placebo (R-Placebo) in Patients with Relapsed/Refractory (R/R) Indolent Non-Hodgkin Lymphoma (iNHL). ASH 2019, Orlando, abstract 347.
- Diefenbach C et al. Polatuzumab Vedotin Plus Obinutuzumab and Lenalidomide in Patients With Relapsed/Refractory Follicular Lymphoma: Primary Analysis of the Full Efficacy Population in a Phase Ib/II Trial. Presented at Session: 623. Mantle Cell, Follicular, and Other Indolent B-Cell Lymphoma—Clinical Studies: Follicular Lymphoma: Biomarkers and Clinical Trials. ASH 2019, Orlando, abstract 126.
- Pastore A et al. Integration of gene mutations in risk prognostication for patients receiving first-line immunochemotherapy for follicular lymphoma: a retrospective analysis of a prospective clinical trial and validation in a population-based registry. The Lancet Oncology 2015; 16: 1111-1122.
- Jurinovic V et al. Evaluation of the m7-FLIPI in Patients with Follicular Lymphoma Treated within the Gallium Trial: EZH2 mutation Status May be a Predictive Marker for Differential Efficacy of Chemotherapy. Presented at Session: 623. Mantle Cell, Follicular, and Other Indolent B-Cell Lymphoma—Clinical Studies: Follicular Lymphoma: Biomarkers and Clinical Trials. ASH 2019, Orlando, abstract 122.
- Morschhauser F et al. Phase 2 Multicenter Study of Tazemetostat, an EZH2 Inhibitor, in Patients with Relapsed or Refractory Follicular Lymphoma. Presented at Session: 623. Mantle Cell, Follicular, and Other Indolent B-Cell Lymphoma—Clinical Studies: Follicular Lymphoma: Biomarkers and Clinical Trials. ASH 2019, Orlando, abstract 123.
- Rummel M et al. Two Years Rituximab Maintenance Vs. Observation after First Line Treatment with Bendamustine Plus Rituximab (B-R) in Patients with Waldenström's Macroglobulinemia (MW): Results of a Prospective, Randomized, Multicenter Phase 3 Study (the StiL NHL7-2008 MAINTAIN trial). Presented at Session: 623. Mantle Cell, Follicular, and Other Indolent B-Cell Lymphoma—Clinical Studies: Clinical Trials in Waldestrom's Macroglobulinemia and Other Indolent B-cell Non-Hodgkin Lymphomas. ASH 2019, Orlando, abstract 343.
- Schuster S et al. Mosunetuzumab Induces Complete Remissions in Poor Prognosis Non-Hodgkin Lymphoma Patients, Including Those Who Are Resistant to or Relapsing After Chimeric Antigen Receptor T-Cell (CAR-T) Therapies, and Is Active in Treatment through Multiple Lines. Presented at Session: Plenary Scientific Session. ASH 2019, Orlando, abstract 6.
- Sun LL et al. Anti-CD20/CD3 T cell–dependent bispecific antibody for the treatment of B cell malignancies. Science Translational Medicine 2015; 7: 287ra270-287ra270.
- Schade J et al. Retrospective Analysis of Gemcitabine and Oxaliplatin (GemOx)-Based Treatment in Patients with Relapsed/Refractory Aggressive B-Cell Non-Hodgkin Lymphoma. ASH 2019, Orlando, abstract 2904.
- Ramchandren R et al. Phase 2 Results of the iR2 Regimen (Ibrutinib, Lenalidomide, and Rituximab) in Patients with Relapsed/Refractory (R/R) Non-Germinal Center B Cell–like (Non-GCB) Diffuse Large B-Cell Lymphoma (DLBCL). Presented at Session: 626. Aggressive Lymphoma (Diffuse Large B-Cell and Other Aggressive B-Cell Non-Hodgkin Lymphomas)—Results from Prospective Clinical Trials: Novel Therapies in Relapsed/Refractory Disease. ASH 2019, Orlando, abstract 761.
- Ujjani CS et al. Phase 1 trial of rituximab, lenalidomide, and ibrutinib in previously untreated follicular lymphoma: Alliance A051103. Blood 2016; 128: 2510-2516.
- Yang Y et al. Exploiting synthetic lethality for the therapy of ABC diffuse large B cell lymphoma. Cancer cell 2012; 21: 723-737.
- Hershkovitz-Rokah O et al. Ibrutinib resistance in mantle cell lymphoma: clinical, molecular and treatment aspects. British Journal of Haematology 2018; 181: 306-319.
- Wang M et al. KTE-X19, an Anti-CD19 Chimeric Antigen Receptor (CAR) T Cell Therapy, in Patients (Pts) With Relapsed/Refractory (R/R) Mantle Cell Lymphoma (MCL): Results of the Phase 2 ZUMA-2 Study. Presented at Session: 623. Mantle Cell, Follicular, and Other Indolent B-Cell Lymphoma—Clinical Studies: Mantle Cell Lymphoma: Frontline and Relapsed Therapies. ASH 2019, Orlando, abstract 754.
- Sabatino M et al. Generation of clinical-grade CD19-specific CAR-modified CD8+ memory stem cells for the treatment of human B-cell malignancies. Blood 2016; 128: 519-528.
- Van Den Neste E et al. Outcome of patients with relapsed diffuse large B-cell lymphoma who fail second-line salvage regimens in the International CORAL study. Bone Marrow Transplantation 2016; 51: 51-57.
- Crump M et al. Outcomes in refractory diffuse large B-cell lymphoma: results from the international SCHOLAR-1 study. Blood 2017; 130: 1800-1808.
- Neelapu SS et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. New England Journal of Medicine 2017; 377: 2531-2544.
- Schuster SJ et al. Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B-Cell Lymphoma. New England Journal of Medicine 2018; 380: 45-56.
- Abramson J et al. Pivotal Safety and Efficacy Results from Transcend NHL 001, a Multicenter Phase 1 Study of Lisocabtagene Maraleucel (liso-cel) in Relapsed/Refractory (R/R) Large B Cell Lymphomas. Presented at Session: 626. Aggressive Lymphoma (Diffuse Large B-Cell and Other Aggressive B-Cell Non-Hodgkin Lymphomas)—Results from Prospective Clinical Trials: Results from CAR T-Cell Trials. ASH 2019, Orlando, abstract 241.
- Liu S et al. Corticosteroids Do Not Influence the Efficacy and Kinetics of CAR-T Cells for B-Cell Acute Lymphoblastic Leukemia. ASH 2019, Orlando, abstract 228.
- Topp M et al. Earlier Steroid Use with Axicabtagene Ciloleucel (Axi-Cel) in Patients with Relapsed/Refractory Large B Cell Lymphoma. ASH 2019, Orlando, abstract 243.
- Frank M et al. Detectable Circulating Tumor DNA 28 Days after the CD19 CAR T-Cell Therapy, Axicabtagene Ciloleucel, Is Associated with Poor Outcomes in Patients with Diffuse Large B-Cell Lymphoma, ASH 2019, Orlando, abstract 884.
- „Lake Eola Park”: © JavierArtPhotography/Adobe