IMW 2017
1. bis 4. März, Neu-Delhi
 Das zunehmende Verständnis der Pathogenese des multiplen Myeloms und damit einhergehend die Entwicklung neuer Ansätze für das therapeutische Vorgehen bei den betroffenen Patienten standen im Fokus des diesjährigen International Myeloma Workshops (IMW) in Neu-Delhi. Immuntherapien bildeten dabei einen der Schwerpunkte des Kongresses. Auch Daten zur Lenalidomid-Erhaltungstherapie wurden präsentiert und zeigten klare Überlebensvorteile dieses therapeutischen Konzepts. Ein Blick über den Tellerrand abseits molekularer Zusammenhänge und neuer Therapien regte auf dem diesjährigen IMW zusätzlich zum Nachdenken an.
Das zunehmende Verständnis der Pathogenese des multiplen Myeloms und damit einhergehend die Entwicklung neuer Ansätze für das therapeutische Vorgehen bei den betroffenen Patienten standen im Fokus des diesjährigen International Myeloma Workshops (IMW) in Neu-Delhi. Immuntherapien bildeten dabei einen der Schwerpunkte des Kongresses. Auch Daten zur Lenalidomid-Erhaltungstherapie wurden präsentiert und zeigten klare Überlebensvorteile dieses therapeutischen Konzepts. Ein Blick über den Tellerrand abseits molekularer Zusammenhänge und neuer Therapien regte auf dem diesjährigen IMW zusätzlich zum Nachdenken an.
Liebe Kolleginnen und Kollegen,
der nur alle zwei Jahre stattfindende International Myeloma Workshop (IMW) lud vom 1. bis zum 4. März 2017 zu seiner 16. Ausgabe in die indische Metropole Neu-Delhi ein. Das ist ein weiter Weg, den viele deutschsprachige Kollegen nicht auf sich nehmen konnten. Ein Grund mehr, Ihnen die Fülle an spannenden neuen Informationen hier praxisnah zu präsentieren.
Von vielversprechenden Ansätzen aus der Grundlagenforschung über aktuelle Daten zu etablierten Therapien bis hin zu neuen Erkenntnissen über die Pathogenese der Erkrankung: Der Bericht vom IMW 2017 soll Ihnen dabei helfen, in dem sich schnell wandelnden Feld des multiplen Myeloms den Überblick zu behalten. Ich freue mich sehr über Ihre Rückmeldung, die Sie mir mithilfe der Funktion „Ihre Meinung ist wichtig“ geben können.
Ich wünsche Ihnen eine informative und spannende Lektüre!
Mit kollegialen Grüßen
 Prof. Dr. med. Igor Blau, Charité Campus Benjamin Franklin, Berlin
Prof. Dr. med. Igor Blau, Charité Campus Benjamin Franklin, BerlinMultiples Myelom – vom Tumor der Plasmazellen zu einer hochkomplexen Erkrankung des Knochenmarkstromas und der Immunzellen
Prof. Dr. med. Igor Blau, Charité Campus Benjamin Franklin, Berlin
 Das Tempo der Einführung neuer Substanzen und ganzer Substanzklassen in die Therapie des Multiplen Myeloms (MM) stellt die Ärzteschaft in der täglichen hämatologischen Praxis seit einigen Monaten vor große Herausforderungen. Informationen auf Kongressen, Symposien, Studientreffen oder Treffen von Niedergelassenen mit Klinikärzten werden geradezu aufgesogen. Die Veranstaltungen zu Neuheiten bei Diagnostik und Therapie der bis dato wenig im Fokus stehenden Erkrankung werden ausgesprochen gut besucht und gewinnen durch einen regen Erfahrungsaustausch deutlich an Wert.
Das Tempo der Einführung neuer Substanzen und ganzer Substanzklassen in die Therapie des Multiplen Myeloms (MM) stellt die Ärzteschaft in der täglichen hämatologischen Praxis seit einigen Monaten vor große Herausforderungen. Informationen auf Kongressen, Symposien, Studientreffen oder Treffen von Niedergelassenen mit Klinikärzten werden geradezu aufgesogen. Die Veranstaltungen zu Neuheiten bei Diagnostik und Therapie der bis dato wenig im Fokus stehenden Erkrankung werden ausgesprochen gut besucht und gewinnen durch einen regen Erfahrungsaustausch deutlich an Wert.
Der diesjährige IMW erscheint in diesem Licht von besonderer Bedeutung. Der Ort der Durchführung war lange im Voraus geplant, die Organisation hervorragend und die Gastgeber freundlich und weltoffen. Dennoch war die Teilnahme eingeschränkt. Kollegen aus vielen Ländern hatten keine Möglichkeit teilzunehmen und sogar aus Deutschland reisten delegierte Kollegen aufgrund von Visaproblemen nicht an. Zusätzlich zogen sich einige der üblicherweise die Veranstaltung unterstützenden Firmen unglücklicherweise zurück.
Verdeutlichung molekularer Prozesse
Inhaltlich führte dies allerdings nicht zu Abstrichen. Die Themen waren auf Neuheiten bei der Pathogenese, auf das diagnostische Vorgehen – hier besonders auf die Relevanz der Minimal-residual-disease(MRD)-Diagnostik – und auf die Therapie fokussiert.
Molekulargenetische Methoden finden immer breiteren Eingang in Untersuchungen zur Krankheitsentstehung. Sie dienen beispielsweise zur Beurteilung der therapeutischen Effektivität durch die Bestimmung von Biomarkern. Ein besonderes Highlight war ein Übersichtsvortrag zur molekularen Basis der therapeutischen Wirksamkeit der Immunmodulatoren (IMiDs) von Anjan Thakurta aus New Jersey [1]. Das Zusammenfügen längst bekannter Bausteine der Immunkaskade und neuer Erkenntnisse zu einem immer übersichtlicheren Puzzle ist ein faszinierender Prozess. Beispiele dafür sind die Wirkung von Interleukin-2, die Schlüsselstellung von Cereblon, die Bindung der IMiDs an Cereblon und deren Wirkmechanismus über IKAROS- und AIOLOK-Degradation. Dieses Prinzip des IMiD-Wirkmechanismus ist universell und gilt gleichermaßen bei anderen Erkrankungen wie myelodysplastischen Syndromen (MDS) oder akuter myeloischer Leukämie (AML). Kenneth Anderson ging in der „Keynote Lecture“ ebenfalls auf den Wirkmechanismus der IMiDs ein [2]. Aus seinem Labor kommen Daten von Experimenten, in denen die Blockade des TP53-Rezeptors im Tumor mittels neuer immunmodulierender Wirkstoffe untersucht wurde – ein Beispiel für weiterführende Ansätze der Targettherapie.
Die Vorstellung der Untersuchungsergebnisse der zellulären und regulatorischen Prozesse im Immunsystem erhielt den größten Raum in den Sessions.
„Das Multiple Myelom ist eine Tumorerkrankung der Plasmazellen, eine Krankheit des Microenvironments und des Immunsystems.“ Prof. Dr. Ivan Borrello
Nicht die präklinische Grundlagenforschung hat zu entscheidenden Erkenntnissen bei der Klärung der Gewichtung dieser drei pathogenetischen Säulen (Abb. 1) geführt, sondern die klinische Forschung. Dabei spielten vor allem Phänomene während der Behandlung eine Rolle, die einer Ex-vivo-Klärung bedurften. Herausragend war nicht nur die Diskussion um die Immuntherapie und deren Wirkmechanismus. Ebenso interessant waren die neuen Erkenntnisse zu Veränderungen des Microenvironments des Knochenmarks [3].
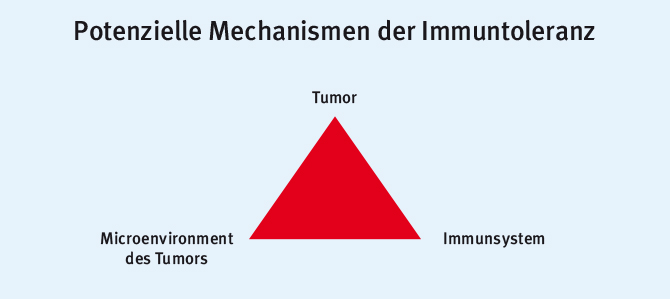 Abb. 1: Mechanismen der Immuntoleranz (modifiziert nach [4])
Abb. 1: Mechanismen der Immuntoleranz (modifiziert nach [4])Sowohl Daten zur Behandlung mit den neuen Proteasominhibitoren als auch zur Wirksamkeit der Immuntherapien wurden dargelegt.
Immuntherapeutische Ansätze beim Myelom haben eine ungeahnte Breite erlangt.
Da die Beeinflussung des Immunsystems als eine Behandlungssäule des MM zunehmend von klinischem Erfolg gekrönt ist, haben die grundlagenmedizinischen Untersuchungen einen besonderen Schub erfahren. Yi Lin von der Mayo Klinik präsentierte erste Daten zu IgG-(anti-BCMA [CD269], EM901, Bi-FAB) und nicht-IgG-(Bi 836909)bispezifischen Antikörpern [5]. In Mausversuchen wurden erstaunliche Effekte gesehen, die bei Betrachtung der präklinischen Daten der Wirksamkeit von CAR-T-Zellen in nichts nachstehen.
Die T-Zell-Therapie fand ebenfalls Widerhall in den Vorträgen, wobei die Daten vom ASH-Kongress vertiefend präsentiert wurden. Adam Cohen vom Abramson Cancer Center erläuterte T-Zell-Therapiestrategien beim MM, angefangen mit der Donorlymphozyteninfusion (DLI) nach allogener Stammzelltransplantation bis hin zu den Entwicklungen von CAR-T-Zellen gegen CD19 und CD269 (BCMA) [6]. Die Erfolge beider Ansätze sind unbestritten und geben Hoffnung für weitere Entwicklungen. Die Gruppe um James Kochenderfer forciert dabei die klinische Umsetzung der CD269-gerichteten T-Zellen. Cohen verwies auf die von dieser Gruppe auf dem ASH-Kongress demonstrierten Daten zur Toxizität der Behandlung. Dabei traten lange andauernde Aplasien (bis 40 Tage) und ein schweres Zytokin-Release-Syndrom auf, was allerdings gut durch eine Prophylaxe und Therapie mit monoklonalen Antikörpern gegen IL-6 oder IL6-Rezeptor (Siltuximab, Tocilizumab) kontrolliert werden kann [7].
Fazit
- Ansätze aus der Grundlagenforschung erhalten immer größere Bedeutung.
- Vielversprechende Ansätze sind bispezifische Antikörper oder CAR-T-Zellen gegen CD19 und CD269.
Überlebensvorteil durch eine Lenalidomid-Erhaltungstherapie
Unzweifelhaft basiert der nun schon im zweiten Jahrzehnt erfolgreich praktizierte Einsatz der immunmodulierenden Substanzen (IMiDs) auf ihrer dualen Wirkungsweise:
„IMiDs sind tumortoxisch und immunaktiv.“ Dr. Anjan Thakurta
Das klinische Anwendungsspektrum ist ungewöhnlich breit und die potenziellen Kombinationen mit anderen Antimyelomtherapeutika sind schier unbegrenzt. Philip McCarthy präsentierte ein Update der Ergebnisse der Metaanalyse zur Erhaltungstherapie mit 10 mg Lenalidomid nach Hochdosistherapie mit Melphalan und autologer Stammzelltransplantation [8]. Aus ursprünglich 17 Studien, die die Erhaltungstherapie mit Lenalidomid geprüft hatten, wurden nach Evidenz drei Studien ausgesucht (Abb. 2). Damit stehen die Daten auf breiter Basis und können als wirklicher Leitfaden für eine Anwendung in der klinischen Praxis herangezogen werden.
 Abb. 2: Studienauswahl für die Metaanalyse zur Erhaltungstherapie mit Lenalidomid (modifiziert nach [8])
Abb. 2: Studienauswahl für die Metaanalyse zur Erhaltungstherapie mit Lenalidomid (modifiziert nach [8])Der Ruf nach einem Überlebensvorteil durch die Einführung neuer Therapien wird hier eindrucksvoll beantwortet. Die Präsentation der Kurven führt immer wieder zu breiter Zustimmung hinsichtlich des Einsatzes von niedriger dosiertem Lenalidomid in der Erhaltungstherapie. Auch nach zehn Jahren ist der Median beim Gesamtüberleben (OS) nicht erreicht (Abb. 3). Der Vorteil für die Patienten spiegelt sich besonders in der nun festgefügten und mehrfach belegten Aussage wider: In den letzten zwei Dekaden hat sich die mittlere Lebenserwartung von Patienten mit Myelom von drei auf über zehn Jahre verlängert. Diese Aussage ist von praktischer Relevanz für alle Ärzte, die mit Patienten in Kontakt kommen. Dies gilt sowohl für Hämatologen wie auch für Orthopäden, Unfallchirurgen und für die internistischen und hausärztlichen Kollegen.
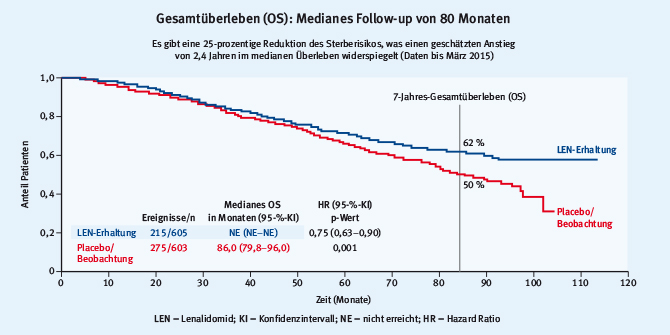 Abb. 3: Gesamtüberleben bei Patienten mit Lenalidomiderhaltung im Vergleich zu Placebo (modifiziert nach [8])
Abb. 3: Gesamtüberleben bei Patienten mit Lenalidomiderhaltung im Vergleich zu Placebo (modifiziert nach [8])Lenalidomiderhaltung und Sekundärmalignome
Die Frage nach dem medizinischen „Preis“ dieser IMiD-Dauerbehandlung wird in diesem Zusammenhang immer wieder aufgeworfen. Ist das PFS2 – also die Antwort auf die Rezidivtherapie nach Lenalidomiderhaltung – schlechter? Bezahlen die Patienten letztlich nach der Erhaltungstherapie mit einer dann aggressiver verlaufenden Erkrankung? Hierzu referierte Gareth Morgan die Ergebnisse der genetischen Analysen von Rezidivpatienten nach Lenalidomiderhaltung aus der britischen Myeloma-XI-Studie [9, 10]: In einer vorläufigen Untersuchung von 70 Patientenpaaren wurde die durchschnittliche Mutationsbelastung mittels „Next Generation Sequencing“ bestimmt. Danach wurden bei Diagnose im Lenalidomiderhaltungsarm durchschnittlich 37 und im Kontrollarm 34 Mutationen detektiert. Im Progress wurden durchschnittlich 34 (Lenalidomiderhaltungsarm) beziehungsweise 44 (Kontrollarm) Mutationen detektiert. Diese Unterschiede waren statistisch nicht signifikant. Auch McCarthy konnte in seinen Ausführungen einen wichtigen, entwarnenden Hinweis zu dieser Diskussion beisteuern. Nach nunmehr zehn Jahren haben sich die Daten zur Inzidenz von Sekundärneoplasien erhärtet. In Abb. 4 sind die Todesursachen übersichtlich dargestellt – Patienten mit der Diagnose Multiples Myelom sterben mit hoher Wahrscheinlichkeit auch an dieser Diagnose und eher unwahrscheinlich an anderen Ursachen, zu denen die Zweittumore gehören.
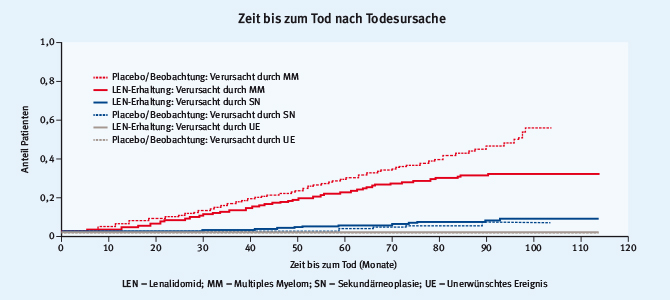 Abb. 4: Sterberate nach Todesursache und Behandlungsarm bei Patienten mit Lenalidomiderhaltung und Patienten mit Placebo (modifiziert nach [8])
Abb. 4: Sterberate nach Todesursache und Behandlungsarm bei Patienten mit Lenalidomiderhaltung und Patienten mit Placebo (modifiziert nach [8])Fazit
- Eine Lenalidomid-Erhaltungstherapie geht mit einem längeren Gesamtüberleben einher.
- Sekundärmalignome sind unter Lenalidomid-Erhaltungstherapie nicht häufiger.
Antikörper in der Myelomtherapie
„Fast meint man, die Hinzunahme der Antikörper in gängige Therapieschemata revolutioniert die Myelomtherapie. Manche sprechen von Heilung.“ Prof. Dr. Igor Blau
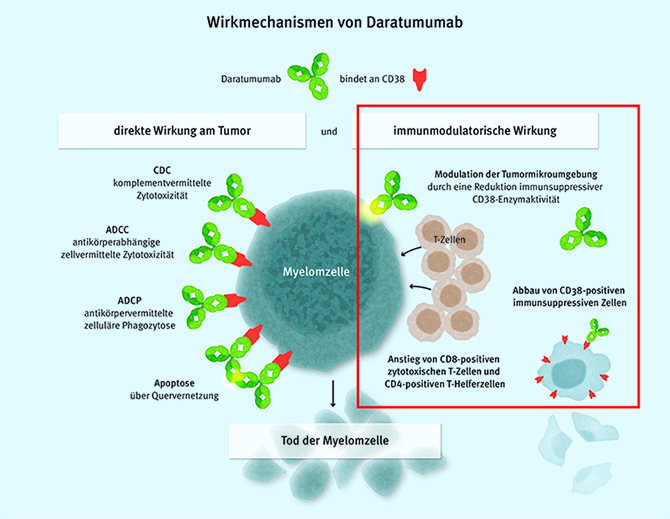
Nachdem zunächst von der tumortoxischen Wirksamkeit von Daratumumab ausgegangen wurde, ist spätestens seit den Arbeiten der Niederländer um Krejcik J [11] klar, dass die Antikörper und besonders die gegenwärtig in die Klinik eingeführten Elotuzumab und Daratumumab immunmodulierende Aktivitäten haben, die (wahrscheinlich) ihr eigentliches Wirkprinzip darstellen (Abb. 5).
Dem klinischen Einsatz sind nun keine Grenzen gesetzt: Ajai Chari konnte die Kombination Daratumumab+Pomalidomid+Dexamethason in einer Phase-Ib-Studie prüfen und die Ergebnisse der Behandlung von 103 Patienten vorstellen, die im Median vier Vorbehandlungen hatten [14]. Alle Patienten waren mit Lenalidomid und Bortezomib vorbehandelt, fast alle waren refraktär (89% und 71%). Die Gesamtansprechrate bei diesen vorbehandelten, IMiD-refraktären Patienten lag bei 60% und es wurden 17% komplette Remissionen beobachtet (Tab. 1).
 Tab. 1: Ergebnisse einer Phase-Ib-Studie von Daratumumab+Pomalidomid+Dexamethason bei Patienten mit median vier Vorbehandlungen (modifiziert nach [14])
Tab. 1: Ergebnisse einer Phase-Ib-Studie von Daratumumab+Pomalidomid+Dexamethason bei Patienten mit median vier Vorbehandlungen (modifiziert nach [14])Die Nebenwirkungen waren gering und beschränkten sich auf die knochenmarktoxischen Folgen der Applikation – 77% Neutropenien, 28% Anämien und 19% Thrombozytopenien ≥ Grad 3. Die Prüfung dieser Therapie erfolgt nun in weiteren Studien.
Jesus San-Miguel konnte beim Update der POLLUX-Studie auf den hohen Anteil MRD-negativer Patienten verweisen [15]: Dieser erreichte fast 30% nach zwei Jahren Therapie im Lenalidomid+Daratumumab-Arm. Die Ergebnisse der Studie, die erstmals beim EHA-Kongress 2016 präsentiert wurden, sind konsistent und belegen weiterhin die hohe Wirksamkeit dieser immunaktiven Kombination. Die Hoffnung auf einen Durchbruch in der Myelomtherapie wächst weiter.
Unsere eigenen Studiendaten mit dem dritten, in klinischer Prüfung befindlichen monoklonalen Antikörper gegen CD38, MOR202, belegen die Wirksamkeit als Monosubstanz und in der Kombination sowohl mit Lenalidomid als auch mit Pomalidomid [16]. Eine Fortsetzung des Studienprogramms scheint aufgrund der guten Ergebnisse gerechtfertigt. Patienten sind unter Monotherapie bereits weit über ein Jahr progressionsfrei. Die Applikation ist praktisch nebenwirkungs- und infusionsreaktionsfrei.
Paul Richardson konnte erste Daten aus einer Phase-Ib-Studie mit Pomalidomid+Isatuximab+Dexamethason präsentieren [17]. Zwar ist die Patientenzahl noch gering (n = 20), doch die Ansprechraten können diejenigen aus den Studien mit Daratumumab+Pomalidomid in einer ähnlichen, zu 80% IMiD-refraktären Patientengruppe bestätigen. In den Gruppen mit dem niedrigsten und mittleren Dosisregime erreichten 64% der Patienten mindestens eine partielle Remission.
Es wurden noch weitere immuntherapeutische Ansätze (wie beispielsweise mit CAR-T-Zellen gegen CD19 und gegen CD269) und Vakzinierungskonzepte präsentiert, die bereits Eingang in die Klinik gefunden haben. Ebenso wurden Untersuchungen zur Wirksamkeit von biphänotypischen Antikörpern vorgestellt, die noch im Labor stattfinden. Dies belegt die Vielfalt der zukünftigen Behandlungsvarianten.
Fazit
- Immuntherapien waren der Schwerpunkt des diesjährigen IMW.
- Antikörper wirken wahrscheinlich eher immunmodulierend als tumortoxisch.
- Antikörper zeigen auch bei refraktären Patienten eine gute Wirksamkeit bei relativ wenigen Nebenwirkungen.
Generationenwandel bei Proteasominhibitoren
„Die Proteasominhibition bleibt ein wichtiges Backboneprinzip der nichtchemotherapeutischen Behandlung des Multiplen Myeloms.“ Prof. Dr. Igor Blau
Der Head-to-Head-Vergleich von Carfilzomib und Bortezomib jeweils in Kombination mit Dexamethason in der ENDEAVOR-Studie dokumentiert die Effektivität einer Zweifachkombination mit einem Proteasominhibitor der zweiten Generation [18]. Am letzten Kongresstag wurden als Highlight des Kongresses die Ergebnisse der Analyse des Gesamtüberlebens aus der ENDEAVOR-Studie präsentiert. Im Median war das Überleben in der Carfilzomibgruppe um 7,6 Monate verlängert. Das mediane Gesamtüberleben betrug 47,6 Monate in der Carfilzomibgruppe gegenüber 40 Monaten in der Bortezomibgruppe (HR = 0,79; 95-%-KI = 0,65-0,96). Damit wird als harter Endpunkt ein signifikant verbessertes Gesamtüberleben präsentiert. Carfilzomib bestätigt damit seine hohe Wirksamkeit in der Rezidivtherapie und seine herausgehobene Stellung in der Myelomtherapie überhaupt als potenzielle Erstliniensubstanz. Dies hatte sich ähnlich bereits in der ASPIRE-Studie gezeigt, in der ebenfalls eine Verbesserung des Gesamtüberlebens belegt werden konnte [19].
Im Gegensatz dazu haben die hier von Thierry Facon präsentierten Ergebnisse der CLARION-Studie die Nichtüberlegenheit von Carfilzomib+Melphalan+Prednisolon (KMP) gegenüber dem Standard Bortezomib+Melphalan+Prednisolon (VMP) dokumentiert (PFS 22,3 vs. 22,1 Monate). Die Studie verfehlte ihren primären Endpunkt – die Überlegenheit im PFS von KMP gegenüber VMP [20]. In diesem Vortrag wurde, wie auch von Roberto Mina [21], auf Probleme mit Organtoxizitäten unter Carfilzomib aufmerksam gemacht. Dies stellt insbesondere in Kombination mit klassischen Chemotherapeutika wie Melphalan ein Problem dar. Die Analyse von drei Phase-I-Studien zur Primärtherapie bei Nicht-Transplantations-Kandidaten ergab eine Gesamtinzidenz von kardiovaskulären Nebenwirkungen von 42% und von schweren Nebenwirkungen > Grad 3 von 17%. Die Publikation dieser Daten ist von praktischer Bedeutung für die tägliche Betreuung der Patienten. Mina gab diesbezüglich Empfehlungen zur Vorgehensweise bei Patienten mit kardiovaskulären Vorerkrankungen. Ein wichtiger Hinweis ist, dass zumindest eine strenge Blutdruckeinstellung zu erfolgen hat, um das Risiko „thorakaler Ereignisse“ zu minimieren.
Die präsentierten Ergebnisse der CHAMPION-2-Studie, in der eine Kombination aus Carfilzomib, Cyclophosphamid und Dexamethason getestet wurde, sprechen für Carfilzomib-Kombinationsschemata ohne Melphalan und belegen bereits die Wirksamkeit eines weniger toxischen Einsatzes [22].
Eine vertiefende Analyse der CASTOR-Studie dokumentierte die Wirksamkeit einer Bortezomib-basierten Daratumumab-Kombination [23]. In den von Suzanne Lentzsch aus New York (ehemals Berlin-Buch) vorgestellten Ergebnissen wurde der Median des PFS in der Gruppe der Patienten, die in der zweiten Linie mit Daratumumab+Bortezomib+Dexamethason behandelt wurden, noch nicht erreicht (HR = 0,22 (!)).
Fazit
- Carfilzomib zeigt eine hohe Wirksamkeit in der Rezidivtherapie und stellt eine potenzielle Erstliniensubstanz dar.
- Bei der Kombination von Carfilzomib mit klassischen Chemotherapeutika kann es zu problematischen Organtoxizitäten kommen.
- Eine strenge Blutdruckeinstellung bei Patienten mit kardiovaskulären Vorerkrankungen ist unter einer Therapie mit Carfilzomib zu empfehlen.
- Bortezomib in Kombination mit Daratumumab stellt eine wirksame Option dar.
Spezifischere Therapie durch Biomarker?
„Selinexor, Venetoclax, Jak-Inhibition, neue Antikörper und HDAC-Inhibitoren, neue IMiDs und Proteasominhibitoren – die Therapieneuerungen gehen weiter.“ Prof Dr. Igor Blau
Die Vorhersage des Ansprechens auf eine bestimmte Therapie mit Hilfe von Biomarkern würde Behandlungsentscheidungen erleichtern und den Medikamenteneinsatz effektiver machen. Eine solche Hoffnung ist mit dem Einsatz des BCL-2-Inhibitors Venetoclax verbunden. Philipp Moreau stellte erste Ergebnisse einer Phase-Ib-Studie mit Venetoclax in Kombination mit Bortezomib vor [24]. Die Ansprechraten bei den behandelten 66 Patienten waren bei Patienten mit ein bis drei vorherigen Therapien annähernd bei 90% (Abb. 6).
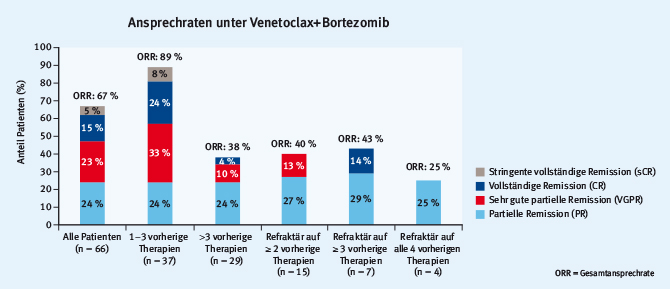 Abb. 6: Ansprechraten in einer Phase-Ib-Studie mit Venetoclax+Bortezomib (modifiziert nach [24])
Abb. 6: Ansprechraten in einer Phase-Ib-Studie mit Venetoclax+Bortezomib (modifiziert nach [24])Die Ergebnisse einer Monotherapiestudie mit Venetoclax und der mögliche Stellenwert dieser Targettherapie bei der aktuellen Myelombehandlung waren Bestandteil der Präsentation von Shaji Kumar [25]. So ist die Wirksamkeit bei Patienten mit t(11;14) – also der Translokation unter Beteiligung des BCL-2-Gens – deutlich höher (bis 90%) als bei Patienten ohne diese Translokation (59%) [25]. Der Unterschied ist dennoch zu gering, um eine Unterscheidung von Patientengruppen anhand dieses Biomarkers zu rechtfertigen.
Neue Hoffnung durch neue Wirkstoffklasse
Eine besondere Hoffnung bei den Ärzten von Myelompatienten liegt auf der Entwicklung eines Medikamentes, das bisher in Studien eine gute Wirksamkeit als Monosubstanz und insbesondere als Bortezomib-Kombinationspräparat gezeigt hat (siehe auch Bericht vom ASH-Kongress 2016) [26]. Als ersten Vertreter der Klasse der XPO1-Inhibitoren stellte Sagar Lonial die Substanz Selinexor vor. Er würdigte dabei die bereits präsentierten Studiendaten ebenso wie die in Initiierung befindliche BOSTON-Studie, an der auch einige deutsche Zentren teilnehmen werden [27]. Selinexor bietet einen therapeutischen Ansatz, von dem bald auch Patienten hierzulande profitieren werden.
Deshalb haben die Hinweise auf die Nebenwirkungen des Präparats besondere Bedeutung. Sie ähneln eher denen klassischer Chemotherapeutika: Übelkeit (Grad 1-2 = 59%; Grad 3-4 = 0%), Inappetenz (Grad 1-2 = 41%; Grad 3-4 = 0%), Fatigue (Grad 1-2 = 30%; Grad 3-4 = 6%) und Thrombozytopenie (Grad 1-2 = 0%; Grad 3-4 = 18%). Auf die vergleichenden Wirksamkeitsdaten der Phase-III-Studien können wir gespannt sein.
Fazit
- Die Behandlung mit Venetoclax zeigt hohe Ansprechraten.
- Selinexor bietet einen vielversprechenden neuen Therapieansatz.
„Der 16. IMW eröffnet ein neues Kapitel zum Verständnis der Krankheitsgenese des Multiplen Myeloms.“ Prof. Dr. Igor Blau
Hohe wissenschaftliche Qualität
Der 16. IMW markierte eine Zäsur im Verständnis des Multiplen Myeloms. Im Unterschied zum römischen Treffen vor knapp zwei Jahren, bei dem sich die Firmen in der Huldigung der neuen Zweitgenerationssubstanzen der nichtchemotherapeutischen Dekade überschlugen, war dieser Kongress charakterisiert durch wissenschaftliche Tiefe. Dies umfasste die Vorstellung neuer Hypothesen zur Pathogenese und zur Wirkungsweise der neuen Therapeutika, die teilweise durch imposante Daten untermauert wurden. Die Satellitensymposien von Janssen, Celgene, Amgen, BMS und Takeda waren angefüllt von hervorragenden Beiträgen erstklassiger Wissenschaftler mit Darstellungen von molekularen und zellulären Zusammenhängen bei Krankheitsentwicklung und Behandlung. Für mich war die Darstellung der Wirkungsweise der IMiDs durch Anjan Thakurta [1] der Beweis für eine mögliche effektive Zusammenarbeit von pharmazeutischer Industrie und unserer eigenen Forschung. Das Gleichgewicht in der Medizin, das auf dem Verständnis der Pathogenese von Erkrankungen und deren daraus hergeleiteter Behandlung beruht, kann so wiederhergestellt werden.
Anlass zum Nachdenken
Die Beiträge zur Behandlung von Myelompatienten in Indien und Lateinamerika und die folgende Diskussion dieser Beiträge [2, 28, 29] ebenso wie der Vortrag von J.L. Harousseau [30] demonstrierten die Zerrissenheit der Welt hinsichtlich der Myelombehandlung. Das vollständige Spektrum der durch die amerikanische Food and Drug Administration (FDA) und die europäische European Medicines Agency (EMA) zugelassenen Therapien wird von Krankenversicherungen nur in den USA und Deutschland erstattet, wobei in den USA dahingehend einige Unsicherheiten bestehen. Das Gefälle innerhalb Europas erscheint klein im Vergleich zum Gefälle gegenüber Brasilien, wo weder Melphalan noch Cyclophosphamid ausreichend verfügbar sind. Im Land produziertes Bortezomib und Lenalidomid sind dagegen für alle Myelompatienten billig erhältlich. Gleiches gilt auch für Indien. Die Auseinandersetzung hierzu war hart und kritisch, aber öffentlich. Die auf Ausgleich bedachte Stellungnahme von Paul Richardson in der Diskussion war dabei beachtenswert. So hat dieser Kongress in Indien auch ohne den Besuch der Straßen von Neu-Delhi die extremen ökonomischen Widersprüche unserer Welt offengelegt. Er fordert wenigstens zum Nachdenken auf. Vielleicht war das sein wichtigster Beitrag zur Lösung des fortbestehenden Problems des Multiplen Myeloms (auf der Erde).
Quellen
Die angegebenen Abstract-Nummern entsprechen den Nummern im Abstract-Buch.
- Thakurta A. Insights into molecular mechanisms of IMIDS. Presented at Industry-Sponsered Symposium: Optimizing immunomodulation for long-term myeloma disease control, IMW 2017, New Delhi.
- Anderson KC. Keynote Lecture: Targeting Achilles Heels in Myeloma. Presented at IMW 2017, New Delhi.
- Chesi M. In vitro models for drug development. Presented at Invited Program: Relapsed Multiple Myeloma, IMW 2017, New Delhi.
- Borrello I. Immunologic basis for Myeloma Therapy. Presented at Industry-Sponsored Symposium: Optimizing immunomodulation for long-term myeloma disease control, IMW 2017, New Delhi.
- Lin Y. Bi-specific antibodies in multiple myeloma. Presented at Invited Program: Immuno-Oncology, IMW 2017, New Delhi.
- Cohen A. Cellular immunotherapy for myeloma. Presented at Invited Program: Immuno-Oncology, IMW 2017, New Delhi.
- Ali SA et al. T cells expressing an anti-B-cell maturation antigen chimeric antigen receptor cause remissions of multiple myeloma. Blood 2016; 128: 1688-1700.
- McCarthy P et al. Lenalidomide (LEN) Maintenance Following High-Dose Melphalan and Autologous Stem Cell Transplant (ASCT) in Patients (Pts) With Newly Diagnosed Multiple Myeloma (MM): A Meta-Analysis of Overall Survival (OS). Presented at Simultaneous Oral Session: Initial Therapy and Transplant, OP-010, IMW 2017, New Delhi.
- Morgan G. Myeloma XI, maintenance and clonal evolution. Presented at Industry-Sponsored Symposium: Optimizing immunomodulation for long-term myeloma disease control, IMW 2017, New Delhi.
- Jackson GH et al. Lenalidomide Is a Highly Effective Maintenance Therapy in Myeloma Patients of All Ages; Results of the Phase III Myeloma XI Study, ASH 2016, San Diego, abstract 1143.
- Krejcik J et al. Daratumumab depletes CD38(+) immune regulatory cells, promotes T-cell expansion, and skews T-cell repertoire in multiple myeloma. Blood 2016; 128: 384-394.
- Palumbo A et al. Phase 3 randomised controlled study of daratumumab, bortezomib and dexamethasone versus bortezomib and dexamethasone in patients with relapsed or refractory multiple myeloma: CASTOR. Presented at Oral Presentation: Late Breaking Session, EHA 2016, Kopenhagen, abstract LB2236.
- Dimopoulos MA et al. An open-label, randomised phase 3 study of daratumumab, lenalidomide, and dexamethasone (DRd) versus lenalidomide and dexamethasone (Rd) in relapsed or refractory multiple myeloma (rrMM): POLLUX. Presented at Presidential Symposium, EHA 2016, Kopenhagen, abstract LB2238.
- Chari A et al. Phase 1b Study of Daratumumab plus Pomalidomide and Dexamethasone in Relapsed and/or Refractory Multiple Myeloma (RRMM) with ≥2 Prior Lines of Therapy. Presented at Simultaneous Oral Session: Treatment of Relapsed Myeloma OP-024, IMW 2017, New Delhi.
- San-Miguel J et al. Depth of Response and MRD with Daratumumab Plus Lenalidomide and Dexamethasone (DRd) vs Lenalidomide and Dexamethasone (Rd) in RRMM: POLLUX. Presented at Simultaneous Oral Session: Treatment of Relapsed Myeloma OP-028, IMW 2017, New Delhi.
- Chatterjee M et al. A phase I/IIa study of the CD38 antibody MOR202 in combination with pomalidomide or lenalidomide in patients with relapsed or refractory multiple myeloma. Presented at Poster Session I PS-110, IMW 2017, New-Delhi.
- Richardson P et al. Preliminary Results From a Phase Ib Study of Isatuximab in Combination with Pomalidomide (Pom) and Dexamethasone (Dex) in Relapsed and Refractory Multiple Myeloma (RRMM). Presented at Simultaneous Oral Session: Treatment of Relapsed Myeloma OP-027, IMW 2017, New-Delhi.
- Siegel DS et al. Updated Results from ASPIRE and ENDEAVOR, Randomized, Open-Label, Multicenter Phase 3 Studies of Carfilzomib in Patients (Pts) with Relapsed/Refractory Multiple Myeloma (RRMM). Presented at Poster Session II PS-254 (d), IMW 2017, New Delhi.
- Stewart AK et al. Carfilzomib, Lenalidomide, and Dexamethasone for Relapsed Multiple Myeloma. New England Journal of Medicine 2015; 372: 142-152.
- Facon T et al. Phase 3 Study (CLARION) of Carfilzomib, Melphalan, Prednisone (KMP) v Bortezomib, Melphalan, Prednisone (VMP) in Newly Diagnosed Multiple Myeloma (NDMM). Presented at Selected Oral Abstracts OP-044, IMW 2017, New Delhi.
- Mina R et al. Cardio-vascular toxicity in newly diagnosed, transplant-ineligible multiple myeloma patients treated with Carfilzomib, cyclophosphamide and dexamethasone: results from an integrated analysis of 3 phase I/II trials. Presented at Simultaneous Oral Session: Initial Therapy and Transplant OP-011, IMW 2017, New-Delhi.
- Boccia R et al. A Multicenter, Open-Label, Phase 1b Study of Carfilzomib, Cyclophosphamide, and Dexamethasone in Newly Diagnosed Multiple Myeloma Patients (CHAMPION-2). Presented at Simultaneous Oral Session: Treatment of Relapsed Myeloma OP-023, IMW 2017, New Delhi.
- Lentzsch S et al. Daratumumab, Bortezomib and Dexamethasone (DVd) vs Bortezomib and Dexamethasone (Vd) in RRMM Based on Prior Lines and Treatment Exposure: CASTOR. Presented at Poster Session II PS-238 (d),IMW 2017, New Delhi.
- Moreau P et al. A Phase 1b Study of Venetoclax Combined with Bortezomib and Dexamethasone in Patients with Relapsed/Refractory Multiple Myeloma. Presented at Simultaneous Oral Session: Treatment of Relapsed Myeloma OP-026, IMW 2017, New Delhi.
- Kumar S et al. Venetoclax as Targeted Therapy for Relapsed/Refractory Multiple Myeloma. Presented at Selected Oral Abstracts OP-045, IMW 2017, New Delhi.
- Bahlis NJ et al. Selinexor in Combination with Bortezomib and Dexamethasone (SdB) Demonstrates Significant Activity in Patients with Refractory Multiple Myeloma (MM) Including Proteasome-Inhibitor Refractory Patients: Results of the Phase I Stomp Trial. Blood 2016; 128: 977-977.
- Lonial S et al. Oral selinexor shows single agent activity enhanced with PI or IMID combinations in refractory multiple myeloma (MM). Presented at Simultaneous Oral Session: Treatment of Relapsed Myeloma OP-022, IMW 2017, New Delhi.
- Pessoa de Magalhaes Filho RJ et al. Analysis of the availability of anti-myeloma drugs and impact on the current management of myeloma in Latin American countries. Presented at Simultaneous Oral Session: Treatment of Relapsed Myeloma OP-025, IMW 2017, New Delhi.
- Chandy M. Keynote Lecture: Hematopoietic stem cell transplantation in India: An odyssey. Presented at IMW 2017, New Delhi.
- Harousseau JL. Point counterpoint: Combinations increase cost and toxicity with no long term benefit. Presented at Invited Program: Relapsed Multiple Myeloma, IMW 2017, New Delhi.
- Bildnachweis: „Qutup Minar Delhi India”: © IbrahimMurat/Fotolia; "Tomb of Safdarjung in New Delhi, India": © donyanedomam/Fotolia