ESMO 2017
8. bis 12. September, Madrid
- Pankreaskarzinom 2017: Auf alten und neuen Wegen zu mehr Therapieerfolg
Dr. med. C. Benedikt Westphalen, Medizinische Klinik und Poliklinik III, Klinikum der Universität München und Comprehensive Cancer Center München - Mammakarzinom – Zwischen Eskalation und Deeskalation: Ergebnisse vom Europäischen Krebskongress 2017 in Madrid
Prof. Dr. med. Cornelia Liedtke, Gynäkologie mit Brustzentrum, Charité-Universitätsklinikum Berlin - Nicht-kleinzelliges Lungenkarzinom (NSCLC) – Highlights vom ESMO-Kongress 2017
Dr. med. Jürgen Alt, III. Medizinische Klinik und Poliklinik und Universitäres Tumorcentrum (UCT), Mainz
 Mit dem Kongress der European Society for Medical Oncology (ESMO) fand vom 8. bis 12. September in Madrid das wichtigste Treffen im Bereich der Onkologie in Europa statt. Die interessantesten Entwicklungen bei Pankreaskarzinom, Mammakarzinom und nicht-kleinzelligem Lungenkarzinom (NSCLC) haben wir für Sie in unserem Bericht zusammengefasst. Einige davon haben das Potenzial, die aktuelle klinische Praxis zu verändern.
Mit dem Kongress der European Society for Medical Oncology (ESMO) fand vom 8. bis 12. September in Madrid das wichtigste Treffen im Bereich der Onkologie in Europa statt. Die interessantesten Entwicklungen bei Pankreaskarzinom, Mammakarzinom und nicht-kleinzelligem Lungenkarzinom (NSCLC) haben wir für Sie in unserem Bericht zusammengefasst. Einige davon haben das Potenzial, die aktuelle klinische Praxis zu verändern.
Liebe Kolleginnen und Kollegen,
der Kongress der European Society for Medical Oncology (ESMO), der in diesem Jahr vom 8. bis 12. September in Madrid tagte, ist mehr als nur der kleine Bruder des Kongresses der American Society of Clinical Oncology (ASCO).
Wir haben für Sie hochkarätige Daten aus großen klinisch relevanten Studien zu den Themen Pankreaskarzinom, Mammakarzinom und nicht-kleinzelliges Lungenkarzinom (NSCLC) zusammengestellt, die auf dem Kongress präsentiert wurden. Ob es dabei um aktuelle Daten zu bestehenden Therapien oder um neue und zielgerichtete Therapien ging: Die Ergebnisse haben das Potenzial, die klinische Praxis zu verändern.
Ihre Meinung zu unseren Berichten ist uns dabei besonders wichtig: Über Ihre Rückmeldung über die Funktion „Ihre Meinung ist wichtig“ würden wir uns freuen. Wir wünschen Ihnen eine angenehme und informative Lektüre.
Mit kollegialen Grüßen
 Dr. med. Jürgen Alt, Universitätsmedizin Mainz
Dr. med. Jürgen Alt, Universitätsmedizin Mainz Prof. Dr. med. Cornelia Liedtke, Charité-Universitätsklinikum Berlin
Prof. Dr. med. Cornelia Liedtke, Charité-Universitätsklinikum Berlin Dr. med. C. Benedikt Westphalen, Universitätsklinikum München
Dr. med. C. Benedikt Westphalen, Universitätsklinikum MünchenPankreaskarzinom 2017: Auf alten und neuen Wegen zu mehr Therapieerfolg
Dr. med. C. Benedikt Westphalen, Medizinische Klinik und Poliklinik III, Klinikum der Universität München und Comprehensive Cancer Center München
 Das Pankreaskarzinom zeichnet sich weiterhin durch eine ausgesprochen schlechte Prognose aus. Dies basiert unter anderem auf der hohen Rate an synchroner Metastasierung, der Neigung zum Rezidiv nach erfolgter Primäroperation, der vergleichsweise hohen Resistenz gegenüber klassischen Chemotherapeutika, einem ausgesprochen komplexen Tumormicroenvironment und den tumorbedingten Symptomen wie Kachexie und systemischer Entzündungsreaktion [1, 2].
Das Pankreaskarzinom zeichnet sich weiterhin durch eine ausgesprochen schlechte Prognose aus. Dies basiert unter anderem auf der hohen Rate an synchroner Metastasierung, der Neigung zum Rezidiv nach erfolgter Primäroperation, der vergleichsweise hohen Resistenz gegenüber klassischen Chemotherapeutika, einem ausgesprochen komplexen Tumormicroenvironment und den tumorbedingten Symptomen wie Kachexie und systemischer Entzündungsreaktion [1, 2].
Der diesjährige Kongress der European Society for Medical Oncology (ESMO) spiegelt die oben erwähnte Entwicklung wider. Zusätzlich zu einigen neuen Medikamenten in Phase-I-Studien und Updates zu laufenden oder kürzlich abgeschlossenen Phase-II-Konzepten, die zum Teil ihren Weg in Phase-III-Studien gefunden haben, wurden viele Daten zu den erwähnten Standardtherapien und ihrem Einsatz in der klinischen Praxis präsentiert.
Therapiekonzepte beim nicht-metastasierten Pankreaskarzinom
Monotherapie oder Kombination in der Adjuvanz nach kurativer Resektion?
Im Rahmen einer sogenannten „controversy session“ unter der Leitung von Herrn Professor Seufferlein (Universität Ulm) diskutierten Professor Manuel Hidalgo (Beth Israel Deaconess Medical Center – pro Monotherapie) und Professor Thierry Conroy (Universität Nancy – pro Kombinationstherapie) die kürzlich veröffentlichten Ergebnisse der ESPAC-4-Studie [7], die in Subgruppen einen Überlebensvorteil für die Kombination von Gemcitabin+Capecitabin (Gem+Cap) in der adjuvanten Situation nach Resektion eines Pankreaskarzinoms zeigte. Beide Diskussionspartner stimmten überein, dass Gem+Cap eine Option für Patienten nach erfolgter Operation darstellt, insbesondere bei Patienten mit niedrigem T-Stadium und einer R0-Resektion. Sie waren sich allerdings auch darüber einig, dass ein unkritischer Einsatz der Kombination auf dem Boden der Studiendaten zumindest diskussionswürdig erscheint. Dementsprechend sollte die Therapieentscheidung mit dem Patienten individuell erörtert werden.
“Obwohl die oben zitierte ESPAC-4-Studie einen deutlichen Vorteil im Gesamtüberleben zeigte, scheint sich die Kombination aus Gemcitabin und Capecitabin nicht universell durchzusetzen. Dementsprechend werden die Ergebnisse der bereits voll rekrutierten APACT-Studie (Gemcitabin versus nab-Paclitaxel+Gemcitabin - NCT01964430) und der italienischen Adjuvanzstudie (Gemcitabin versus FOLFOXIRI - NCT02355119) mit Spannung erwartet.“ Dr. med. C. Benedikt Westphalen
Adjuvante, neoadjuvante und perioperative Therapiekonzepte
Die Arbeitsgruppe um P. A. Philip präsentierte eine Zwischenanalyse zu Wirksamkeit und Sicherheit innerhalb der Phase-II-LAPACT-Studie [8]. In dieser Studie wurden Patienten mit lokal fortgeschrittenem Pankreaskarzinom mit maximal sechs Zyklen nab-Paclitaxel+Gemcitabin (nab-Pac+Gem) behandelt (Induktionsphase). Kam es im Verlauf der Induktion zu einem ausreichenden Therapieansprechen, war eine Operation auch vor Beendigung der Induktionsphase möglich. Sofern es nicht zu einem Progress oder zu inakzeptablen Nebenwirkungen gekommen war, konnten die behandelnden Ärzte am Ende zwischen drei therapeutischen Optionen (Fortführung der Chemotherapie, Radiochemotherapie und Operation) wählen. Innerhalb der Studienpopulation konnten knapp 60 Prozent der Patienten die komplette Induktionstherapie erhalten. Hauptgründe für einen Abbruch der Induktion waren unerwünschte Nebenwirkungen (16,8%) und Fortschreiten der Erkrankung (7,5%). Insgesamt zeigte sich ein gutes Sicherheitsprofil der Kombination aus nab-Pac+Gem mit einer partiellen Ansprechrate von 33,6% und einer Krankheitskontrolle von 66,4% über einen Zeitraum von 24 Wochen. Von den Patienten, die nach Ende der Induktionstherapie weiterbehandelt werden konnten (46 Patienten), wurden 17 Patienten in der Folge einer Radiochemotherapie zugeführt. Bei 16 Patienten erfolgte eine Resektion. Bei 13 Patienten wurde die Chemotherapie fortgeführt. Im Rahmen der Studie wurde zudem eine Erhebung der Lebensqualität durchgeführt [9]. Diese zeigte, dass es unter der Kombination mit nab-Paclitaxel+Gemcitabin bei etwa zwei Dritteln der Patienten zu einer Stabilisierung beziehungsweise Verbesserung der Lebensqualität kommt und dass dieser Effekt bereits kurz nach Therapieeinleitung einsetzt.
“Im nicht-randomisierten (neoadjuvanten) Setting zeigt sich mit der Kombination aus nab-Paclitaxel und Gemcitabin eine gute Wirksamkeit bei guter Verträglichkeit. Neue relevante Sicherheitssignale wurden nicht beobachtet. Die Zukunft wird zeigen, welche therapeutischen Ansätze sich im perioperativen Setting (Adjuvanz beziehungsweise Neoadjuvanz) bewähren werden.“ Dr. med. C. Benedikt Westphalen
Im Rahmen einer randomisierten Phase-II-Studie verglich eine italienische Studiengruppe den Einsatz von sechs Zyklen adjuvanter Therapie mit Gemcitabin (Arm A – 26 Patienten), sechs Zyklen PEXG (Cisplatin+Epirubicin+Gemcitabin+Capecitabin – Arm B – 30 Patienten) und jeweils drei Zyklen PEXG-Polychemotherapie prä- und postoperativ (Arm C – 32 Patienten) [10]. Primärer Endpunkt der Studie war das ereignisfreie Überleben nach zwölf Monaten (EFS). Sekundärer Endpunkt war unter anderem das Gesamtüberleben. Präsentiert wurden die Daten von 22 (Arm A) beziehungsweise jeweils 27 (Arm B und C) Patienten pro Arm. Insgesamt zeigte sich die perioperative Therapie (Arm C, EFS: 18 Monate) sowohl gegenüber adjuvantem PEXG (Arm B, EFS: 12,4 Monate) als auch gegenüber adjuvantem Gemcitabin (Arm A, EFS: 4,8 Monate) im medianen ereignisfreien Überleben überlegen. Das ereignisfreie 1-Jahresüberleben lag bei 23%, 50% und 66% (A/B/C). In Bezug auf Grad-3/4-Nebenwirkungen wurde besonders eine Zunahme der hämatologischen Toxizität im Sinne einer Neutropenie beobachtet. Diese lag bei 23%, 38% bzw. 54% (A/B/C).
“Die Daten zum PEXG-Protokoll aus Italien zeigen, dass eine Intensivierung der adjuvanten Therapie eine Verbesserung der Prognose bewirken könnte. Auch der Einsatz intensivierter Polychemotherapie im Sinne einer perioperativen Therapie scheint denkbar. Allerdings kommt das PEXG-Protokoll auf Grund der deutlich erhöhten Toxizität mit Sicherheit nicht bei allen Patienten in Frage. Auf Grund der geringen Fallzahlen bleibt abzuwarten, ob die hier beschriebenen Konzepte auch in größeren Patientengruppen durchführbar sind und ihre Wirksamkeit beweisen.“ Dr. med. C. Benedikt Westphalen
In genetischen Mausmodellen des Pankreaskarzinoms konnte eine wichtige funktionelle Rolle für das Molekül CTGF (connective tissue growth factor) gezeigt werden [11]. Pamrevlumab ist ein monoklonaler Antikörper gegen CTGF. Im Rahmen einer randomisierten Phase-II-Studie wurde die Kombination aus Pamrevlumab und nab-Pac+Gem (Arm A) versus nab-Pac+Gem (Arm B) im neoadjuvanten Setting getestet [12]. Insgesamt durchliefen 14 von 33 Patienten alle sechs Zyklen der Therapie. Hauptgrund für einen Therapieabbruch waren Krankheitsfortschreiten oder unerwünschte Nebenwirkungen. Im Anschluss an die sechs Zyklen Induktionschemotherapie erfolgte die Beurteilung der Resektabilität. In Arm A wurden sieben von neun Patienten (78%), die sechs Zyklen durchlaufen hatten, als resektabel eingestuft. Bei vier von neun Patienten (45%) erfolgte dann tatsächlich die Resektion. In Arm B durchliefen fünf Patienten alle sechs Therapiezyklen. Nur einer von fünf Patienten wurde als resektabel eingestuft und erfolgreich operiert (siehe Abb. 1).
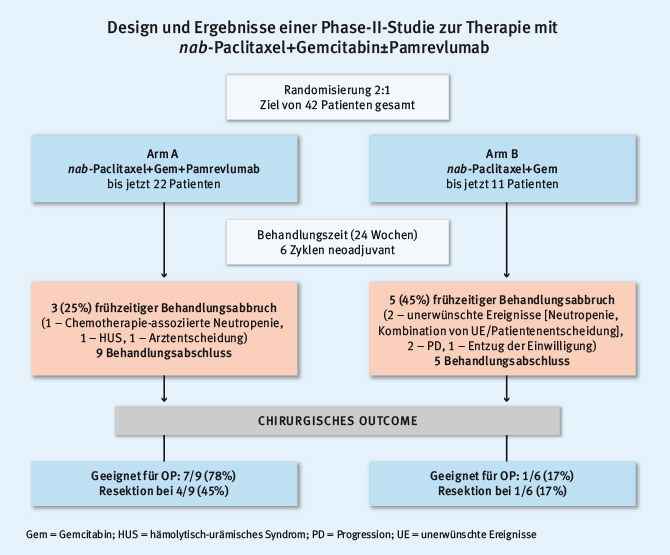 Abb. 1: Design und Ergebnisse einer Phase-II-Studie zum CTGF-Antikörper Pamrevlumab als Ergänzung zur neoadjuvanten Therapie mit Gem+nab-Paclitaxel (modifiziert nach [12])
Abb. 1: Design und Ergebnisse einer Phase-II-Studie zum CTGF-Antikörper Pamrevlumab als Ergänzung zur neoadjuvanten Therapie mit Gem+nab-Paclitaxel (modifiziert nach [12])“Es ist sehr erfreulich, dass nun auch beim Pankreaskarzinom der Weg aus dem relevanten Tiermodell bis in die klinische Studie beschritten wird. Obwohl nur ein kleines Patientenkollektiv untersucht wurde, machen die Resektionsdaten Mut, und der Weg in eine Phase-III-Studie erscheint sinnvoll.“ Dr. med. C. Benedikt Westphalen
Die Sicherheit einer Vakzinierung gegen das nahezu ubiquitär mutierte KRAS-Onkogen im Rahmen einer adjuvanten Chemotherapie mit Gemcitabin steht im Fokus einer norwegischen Arbeitsgruppe [13]. Der experimentelle Impfstoff TG01 führte bei 17 von 19 Patienten zur Bildung von spezifischen T-Zellen gegen KRAS-Peptide. Es traten überwiegend milde allergische Reaktionen im späteren Verlauf der Studie auf, die allesamt gut zu kontrollieren waren. Mit einem medianen krankheitsfreien Überleben von 13,9 Monaten lagen die berichteten Effektivitätsdaten im Bereich historischer Kollektive.
“Adjuvante (und gegebenenfalls personalisierte) Impfstrategien könnten einen weiteren Weg darstellen, das Überleben nach potenziell kurativer Resektion zu verbessern. Die norwegischen Daten zeigen, dass ein solcher Ansatz sicher durchführbar ist und eine spezifische Immunantwort hervorrufen kann.“ Dr. med. C. Benedikt Westphalen
Fazit
- Es kommen zunehmend neoadjuvante und perioperative Studienkonzepte zum Einsatz.
- Die Intensivierung der Chemotherapie wird nun auch im Rahmen potenziell kurativer Therapieansätze untersucht.
- In den nächsten Jahren werden höchstrelevante Studienergebnisse zur intensivierten adjuvanten Therapie beim Pankreaskarzinom erwartet.
Therapie des metastasierten Pankreaskarzinoms
Neue Erkenntnisse aus der Studienlandschaft
Das Pankreaskarzinom zeichnet sich durch ein hochkomplexes Tumormikromilieu aus [14]. Eine Komponente dieses Milieus ist Hyaluronsäure (HA). Im Rahmen von präklinischen Studien konnte gezeigt werden, dass das Molekül PEGPH20 HA abbauen kann. In Kombination mit zytostatischer Therapie ließ sich so präklinisch (und klinisch) ein positiver Effekt erzielen [15, 16]. Im Rahmen der randomisierten Phase-II-HALO-109-202-Studie wurde die Kombination aus nab-Paclitaxel+Gemcitabin mit PEGPH20 (PAG) gegen nab-Paclitaxel+Gemcitabin (AG) getestet (siehe Abb. 2).
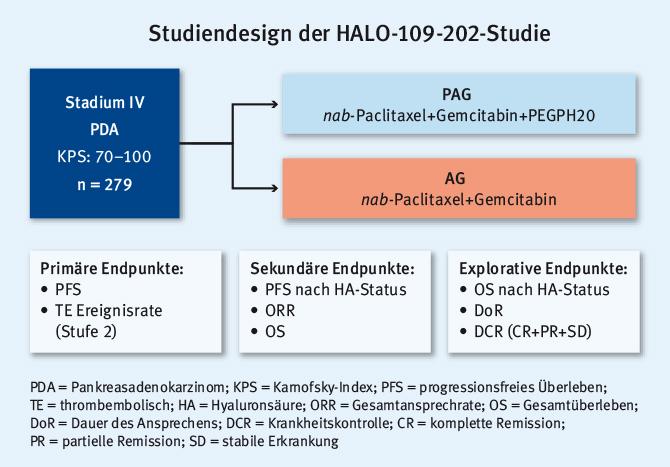 Abb. 2: Design der Phase-II-Studie HALO-109-202 zu PEGPH20 als Ergänzung zur Therapie mit nab-Paclitaxel+Gemcitabin (modifiziert nach [17])
Abb. 2: Design der Phase-II-Studie HALO-109-202 zu PEGPH20 als Ergänzung zur Therapie mit nab-Paclitaxel+Gemcitabin (modifiziert nach [17])Im frühen Verlauf der Studie kam es zu einem deutlichen Anstieg thrombembolischer Ereignisse, sodass ein zwischenzeitlicher Rekrutierungsstopp notwendig wurde. Nach einer Sicherheitsanalyse und der Entscheidung, eine prophylaktische Antikoagulation im Protokoll zu verankern, wurde die Studie fortgesetzt.
Auf dem diesjährigen ESMO wurden nun aktualisierte Daten zur Effektivität des Regimes vorgestellt [17]. Der primäre Endpunkt der Studie war progressionsfreies Überleben (PFS). Das PAG-Schema zeigte sich in der Gesamtpopulation von 279 Patienten gegenüber AG in Bezug auf PFS signifikant überlegen (6,0 Monate versus 5,3 Monate, siehe Tab. 1). Dieser Vorteil des experimentellen Armes wurde noch deutlicher, wenn nur die Patienten mit hohem HA-Gehalt im Stroma analysiert wurden (9,2 Monate versus 5,2 Monate, siehe Tab. 1).
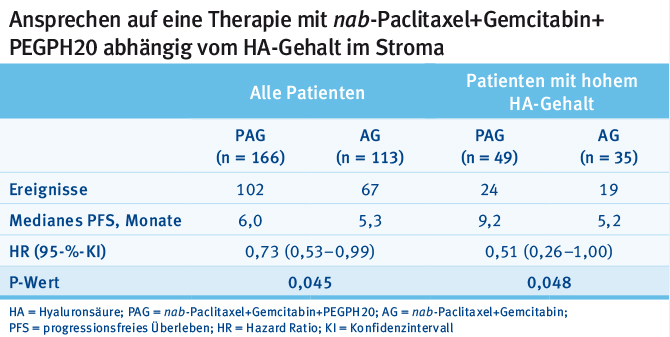 Tab. 1: Ergebnisse der HALO-109-202-Studie (modifiziert nach [17])
Tab. 1: Ergebnisse der HALO-109-202-Studie (modifiziert nach [17])Parallel wurden Daten zum prädiktiven und prognostischen Wert des HA-Gehaltes präsentiert [18]. Hier zeigte sich ein Trend, dass Patienten mit hohem HA-Gehalt im Tumorstroma eine schlechtere Prognose aufwiesen, allerdings von einer Therapie mit PAG deutlich profitierten. In Bezug auf relevante Sicherheitssignale zeigte sich, dass die Hinzunahme einer Antikoagulation mit niedermolekularem Heparin zu einer wirkungsvollen Reduktion der thrombembolischen Komplikationen führte. Eine Zunahme an Blutungskomplikationen wurde nicht beobachtet. Des Weiteren zeigte sich im experimentellen Arm eine deutliche Zunahme an muskuloskelettalen Nebenwirkungen (Krämpfe, Muskel- und Gelenkschmerzen). Diese konnten mit Dosismodifikationen und supportiven Therapiemaßnahmen gut behandelt werden und führten nur in Ausnahmefällen zur Einstellung der Therapie [19]. Basierend auf den Daten und Erfahrungen der hier präsentierten Phase-II-Studie wurde eine randomisierte Phase-III-Studie (HALO-109-301) konzipiert, die nur Patienten mit hohem stromalen HA-Gehalt einschließt. Aktuell rekrutiert die Studie (NCT02715804) in Deutschland noch nicht.
“Die Daten der Phase-II-Studie stimmen zuversichtlich, dass mit der Bestimmung des stromalen Hyaluronsäuregehaltes ein wertvoller Biomarker gefunden wurde, der in Zukunft bei der Therapieentscheidung eingesetzt werden könnte. Die vorläufigen Daten zu progressionsfreiem Überleben bei Patienten mit hohem HA-Gehalt suggerieren, dass besonders diese Patientengruppe von einer Therapie mit PEGPH20 profitiert. Es bleibt zu hoffen, dass sich diese Daten in der HALO-109-301-Studie bestätigen lassen.“ Dr. med. C. Benedikt Westphalen
Eine italienische Studiengruppe präsentierte Daten einer randomisierten Phase-II-Studie, die eine Therapieintensivierung von nab-Paclitaxel+Gemcitabin auf das PAXG(nab-Paclitaxel+Gemcitabin+Capecitabin+Cisplatin)-Regime bei Patienten mit metastasiertem Pankreaskarzinom untersuchte [20]. Das progressionsfreie Überleben nach sechs Monaten (PFS6) wurde als primärer Endpunkt gewählt. Die Autoren berichten von einem PFS6 von 74 % und erreichten damit das gesteckte Ziel (PFS6 von 65 %). Interessanterweise führte die Therapieintensivierung nicht zu einer deutlichen Zunahme an unerwünschten Wirkungen im Studienkollektiv (siehe Tab. 2).
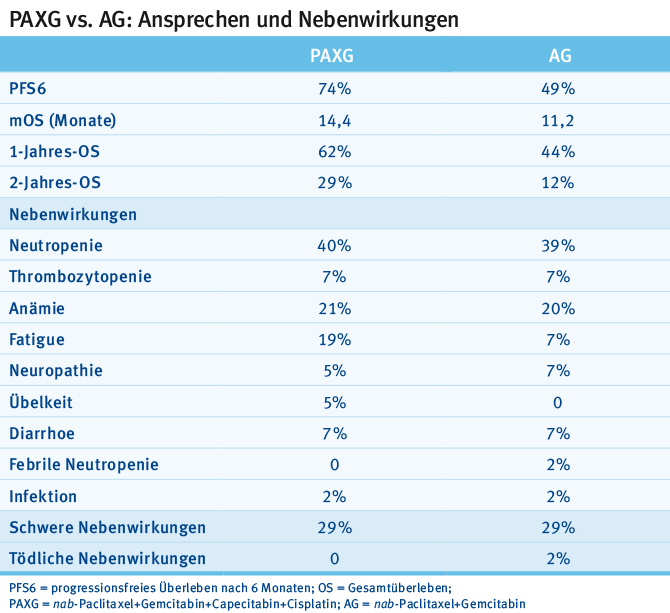 Tab. 2: Progressionsfreies Überleben nach sechs Monaten und Nebenwirkungen unter einer Therapie mit Cisplatin+nab-Paclitaxel+Gemcitabin+Capecitabin versus nab-Paclitaxel+Gemcitabin allein (modifiziert nach [20])
Tab. 2: Progressionsfreies Überleben nach sechs Monaten und Nebenwirkungen unter einer Therapie mit Cisplatin+nab-Paclitaxel+Gemcitabin+Capecitabin versus nab-Paclitaxel+Gemcitabin allein (modifiziert nach [20])“Die Therapieintensivierung im Sinne des PAXG-Regimes scheint im Rahmen einer klinischen Studie machbar und zeichnet sich durch hohe Effektivität aus. Das kaum veränderte Nebenwirkungsprofil überrascht in diesem Zusammenhang. Es bleibt abzuwarten, ob dieses Therapieschema auch in größeren Studienkollektiven durchführbar und effektiv bleibt.“ Dr. med. C. Benedikt Westphalen
Nicht unerwähnt bleiben sollte zudem die YOSEMITE-Studie [21]. In diesem dreiarmigen, doppelblinden und randomisierten Studienkonzept wurde die Kombination aus nab-Paclitaxel+Gemcitabin+Demcizumab getestet. Demcizumab blockt DLL4 und interferiert so mit dem NOTCH-Signalweg. Trotz positiver Signale aus frühen klinischen Prüfungen und einer guten biologischen Rationale verfehlte diese methodisch aufwendige und gut konzipierte Studie ihren primären Endpunkt und blieb dementsprechend negativ.
Fazit
- Die Daten zum stromalen Hyaluronsäuregehalt machen Hoffnung auf einen klinisch relevanten Biomarker zur Therapiesteuerung beim Pankreaskarzinom.
- Die vorläufigen Ergebnisse zur Wirksamkeit von PEGPH20 bei Patienten mit hohem Hyaluronsäuregehalt sind sehr vielversprechend.
- Das veränderte Nebenwirkungsprofil der Kombination aus nab-Paclitaxel+Gemcitabin und PEGPH20 stellt neue Herausforderungen an das Behandlungsteam.
- Das intensivierte PAXG-Regime zeigte hohe Effektivität bei überraschend geringer Zunahme an Toxizität.
Neue Medikamente, Kombinationstherapien und therapeutische Konzepte
LDE225
LDE225 greift therapeutisch in den Sonic-Hedgehog(SHH)-Signalweg ein. Therapeutische Eingriffe in den SHH-Signalweg beim Pankreaskarzinom blieben bis dato erfolglos [22, 23]. Die hier präsentierten Daten der Phase-I-Studie mit LDE225 und nab-Paclitaxel+Gemcitabin zeigten ein gutes Sicherheitsprofil mit ermutigender Effektivität [24]. Die Studie wird durch ein interessantes translationales Begleitprojekt komplettiert. Die anschließende Phase-II-Studie rekrutiert bereits.
“Der Sonic-Hedgehog-Signalweg spielt eine zentrale Rolle im Tumorstroma des Pankreaskarzinoms. Die Möglichkeit, hier erfolgreich therapeutisch intervenieren zu können, würde einen signifikanten Schritt vorwärts bedeuten.“ Dr. med. C. Benedikt Westphalen
PF-04136309
Im Rahmen einer Phase-Ib-Studie wurde die Kombination aus nab-Paclitaxel+Gemcitabin und PF-04136309, einem oral verfügbaren CCR2-Inhibitor, bei Patienten mit metastasiertem Pankreaskarzinom getestet [25]. Mit Hilfe von CCR2-Inhibitoren sollen tumorassoziierte Makrophagen eliminiert werden. PF-04136309 wurde bereits in Kombination mit FOLFIRINOX bei Patienten mit lokal fortgeschrittenem Pankreaskarzinom sicher eingesetzt [26]. Auch in Kombination mit nab-Paclitaxel+Gemcitabin zeigten sich keine unerwarteten Toxizitäten, die einen Einsatz in weiteren klinischen Prüfungen verbieten würden.
Tumor Treating Fields
Tumor Treating Fields (TTF) zeigen beeindruckende Effektivität bei Patienten mit fortgeschrittenen Glioblastomen [27, 28]. TTF sind von extern applizierte elektrische Felder, die über eine Hemmung des Spindelapparates wirken. Patienten mit abdominellen Tumoren tragen während der Therapie einen speziellen Bauchgurt und einen portablen Akku. Im Rahmen der PANOVA-Studie wurde die Sicherheit der Kombination aus TTF und nab-Paclitaxel+Gemcitabin getestet [29]. In Verbindung mit TTF traten keine schwerwiegenden Nebenwirkungen auf. Im Vergleich zu historischen Kontrollen zeigte sich bei Patienten mit metastasierter Erkrankung eine sehr gute Effektivität mit einem progressionsfreien Überleben von 12,7 Monaten. Basierend auf den Ergebnissen der PANOVA-Studie wurde die PANOVA-3 (randomisierte Phase-III-Studie) konzipiert, die als „study in progress“ präsentiert wurde [30].
“In Analogie zu den Anfängen bei Patienten mit Glioblastom erscheint diese neue Behandlungsmodalität zunächst fremdartig. Die ausgesprochen guten Ergebnisse bei Patienten mit Glioblastom und die frühen klinischen Daten zum Pankreaskarzinom machen neugierig auf die randomisierte PANOVA-3-Studie.“ Dr. med. C. Benedikt Westphalen
Pegyliertes humanes Interleukin-10 (IL-10, AM0010)
Patienten mit Pankreaskarzinom erhalten zunehmend Zweitlinientherapien. In dieser Studienpopulation wurde die Kombination aus FOLFOX und pegyliertem humanem IL-10 getestet [31]. Rationale einer IL-10-Therapie ist die erhoffte Expansion tumorspezifischer T-Zellen. Die Kombination aus FOLFOX und IL-10 war, auch in diesem vorbehandelten Kollektiv, sicher und führte zu einer deutlichen Zytokinproduktion und einer Expansion von T-Zellen im peripheren Blut und Tumorgewebe.
CPI-613
CPI-613 greift als erster Vertreter seiner Klasse in den mitochondrialen Stoffwechsel ein. Im Rahmen einer zweistufigen Phase-I-Studie wurden die maximale tolerierte Dosis (Stufe I) und die Sicherheit von CPI-613 in Kombination mit modifiziertem FOLFIRINOX (Stufe II) getestet [32]. Für die 18 Patienten, die in der zweiten Stufe der Studie behandelt wurden, wurden die Effektivitätsdaten präsentiert. Hier zeigte sich bei 61% der Patienten ein zum Teil dauerhaftes Therapieansprechen. Bemerkenswerterweise zeigten sich drei radiologische Komplettremissionen (siehe Abb. 3). Eine randomisierte Phase-II/III-Studie ist in Planung.
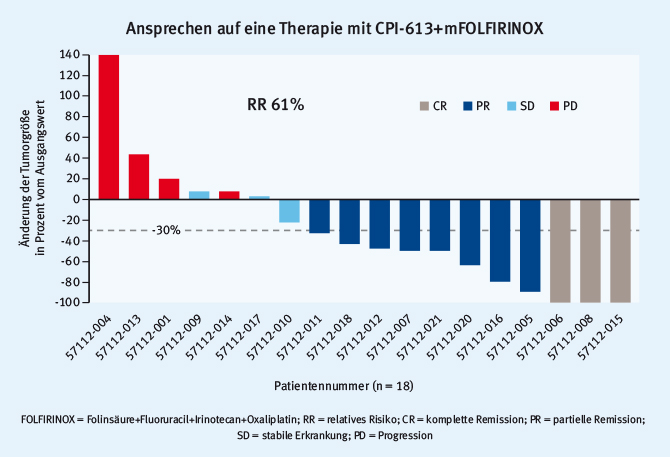 Abb. 3: Effektivitätsdaten von 18 Patienten, die mit einer Kombination aus dem antimitochondrialen Wirkstoff CPI-613 und modifiziertem FOLFIRINOX behandelt wurden (modifiziert nach [32])
Abb. 3: Effektivitätsdaten von 18 Patienten, die mit einer Kombination aus dem antimitochondrialen Wirkstoff CPI-613 und modifiziertem FOLFIRINOX behandelt wurden (modifiziert nach [32])“Die Ansprechraten und die Tiefe des Ansprechens von CPI-613 in Kombination mit FOLFIRINOX sind beeindruckend.“ Dr. med. C. Benedikt Westphalen
L-Asparaginase (Eryaspase)
Asparagin ist für das Überleben vieler Krebszellen essenziell. Dementsprechend wird L-Asparaginase in der Therapie der akuten lymphatischen Leukämie eingesetzt. Die französische Studiengruppe präsentierte auf dem diesjährigen ESMO Daten einer Phase-II-Studie zum Einsatz von Asparaginase innerhalb der Zweitlinientherapie [33]. Die Patienten wurden 2:1 randomisiert und erhielten entweder eine spezielle Aufbereitung von L-Asparaginase (Eryaspase) in Kombination mit FOLFOX oder Gemcitabin oder Chemotherapie ohne Hinzunahme von Eryaspase. In der Gesamtpopulation führte die Kombination aus Chemotherapie und Eryaspase gegenüber der Kontrollgruppe zu einer deutlichen Verbesserung des progressionsfreien Überlebens und des Gesamtüberlebens (26,1 versus 19,1 Wochen). Eine relevante Zunahme der Toxizität wurde nicht beobachtet.
“Die Hinzunahme von Eryaspase im Rahmen der Zweitlinientherapie zeigte vielversprechende Signale bei guter Verträglichkeit. Es bleibt abzuwarten, ob dieser neue Therapieansatz seinen Weg in die Erstlinie und die Behandlungsrealität finden wird.“ Dr. med. C. Benedikt Westphalen
Fazit
- Konsequenterweise werden neue therapeutische Ansätze nun ausschließlich in Kombination mit Polychemotherapieprotokollen getestet.
- Frühe klinische Studien zeigen, dass dieser Ansatz sicher durchführbar ist.
- Tumor Treating Fields zeigen, ähnlich wie bei Hirntumoren, erstaunliche Effektivität bei Patienten mit Pankreaskarzinom.
Behandlungsrealitäten beim Pankreaskarzinom
Einsatz von Gemcitabin+nab-Paclitaxel und FOLFIRINOX im klinischen Alltag
In einer Registerstudie zum Einsatz von Polychemotherapieprotokollen beim Pankreaskarzinom wurden Wirksamkeit und Sicherheit von Gem+nab-Pac und FOLFIRINOX beim fortgeschrittenen Pankreaskarzinom untersucht. Insgesamt wurden 119 Patienten analysiert [34]. Es zeigte sich, dass die Patienten, die mit Gem+nab-Pac behandelt wurden (n = 33), im Mittel älter waren und einen schlechteren Performancestatus aufwiesen. Patienten in der FOLFIRINOX-Gruppe (n = 86) hatten signifikant mehr Metastasen als die Gruppe, die mit Gem+nab-Pac behandelt wurde. Es zeigte sich ein vergleichbares Gesamtüberleben (9 Monate) bei unterschiedlichen Nebenwirkungsprofilen.
“Diese Registerstudie zeigt eindrucksvoll, dass der Vergleich zwischen verschiedenen Therapiestandards außerhalb randomisierter Studien auf Grund von nicht balancierten Gruppen nahezu immer zum Scheitern verurteilt ist. Daten aus diesen Erhebungen können im klinischen Alltag allenfalls als Orientierung dienen.“ Dr. med. C. Benedikt Westphalen
Erstlinientherapie mit Gemcitabin+nab-Paclitaxel – „Real World Data“
QoliXane ist eine prospektive Registerstudie, die Patienten mit nab-Paclitaxel+Gemcitabin als Erstlinientherapie des metastasierten Pankreaskarzinoms prospektiv einschließt [35]. Ziel des Projektes ist es, Daten aus dem klinischen Alltag zu generieren, eine Plattform für translationale Projekte zu etablieren und prospektive Lebensqualitätsdaten zu erfassen. Insgesamt wurden 539 Patienten eingeschlossen. Zum Analysezeitpunkt waren 301 Patienten (56%) am Leben. Die Ergebnisse dieser Studie zur Behandlungsrealität bei Patienten mit Pankreaskarzinom zeigen, dass die Kombination aus Gemcitabin+nab-Paclitaxel im klinischen Alltag gute Sicherheit, Verträglichkeit und Wirksamkeit aufweist:
- Dosismodifikation bei 231 Patienten (43%)
- weitere Therapien bei 209 Patienten (39%)
- 135 Patienten (25%) entwickelten eine Polyneuropathie
- das mediane progressionsfreie Überleben betrug sechs Monate (95-%-KI: 5–6)
- das mediane Gesamtüberleben betrug zehn Monate (95-%-KI: 8–10)
- das 1-Jahres-Gesamtüberleben betrug 40%
- das mediane Überleben nach ECOG-Performancestatus betrug 12/9/5/2 Monate jeweils für ECOG 0/1/2/3 (p < 0,001)
“Diese mit hohem Aufwand betriebene Registerstudie zeigt erneut, dass nab-Paclitaxel+Gemcitabin eine wirksame Erstlinientherapie bei Patienten mit metastasiertem Pankreaskarzinom darstellt. Die prospektive Sammlung von Tumormaterial in dieser Größenordnung ist von unschätzbarem wissenschaftlichen Wert.“ Dr. med. C. Benedikt Westphalen
Intensivierte Chemotherapie bei schlechtem Performancestatus
Viele Patienten mit Pankreaskarzinom präsentieren sich krankheitsbedingt in einem deutlich reduzierten Allgemeinzustand (ECOG 2). Im Rahmen von klinischen Studien ist dieses Kollektiv meist nicht abgebildet. Im Rahmen einer Phase-I/II-Studie wurde zunächst die Verträglichkeit verschiedener Dosierungsschemata von nab-Paclitaxel+Gemcitabin auf ihre Verträglichkeit getestet [36]. Im Phase-II-Teil wurde dann Gemcitabin (1000 mg/m2) in Kombination mit zwei verschiedenen Dosierungen von nab-Paclitaxel (Arm C: 100 mg/m2 oder Arm E: 125 mg/m2) an den Tagen 1/8/15 eines 28-tägigen Zyklus verglichen. Bezüglich Effektivität und Toxizität zeigte sich kein signifikanter Unterschied in den beiden Studienpopulationen (C/E). Das progressionsfreie Überleben lag bei 5,5/6,7 Monaten, die Ansprechrate bei 20,7/22,7% und das Überleben nach sechs Monaten bei 63,8/67,9% (C/E).
“Diese Daten zeigen, dass nab-Paclitaxel+Gemcitabin auch bei Patienten mit schlechtem Performancestatus sicher eingesetzt werden kann. Des Weiteren scheint eine primäre Dosisreduktion von nab-Paclitaxel keine schwerwiegende Effektivitätseinbuße zu bedingen.“ Dr. med. C. Benedikt Westphalen
Fazit
- Im klinischen Alltag zeichnet sich die Kombination aus nab-Paclitaxel+Gemcitabin durch gute Wirksamkeit und ein gutes Sicherheitsprofil aus.
- Auch ältere Patienten mit eingeschränktem Performancestatus können effektiv und sicher mit nab-Paclitaxel+Gemcitabin behandelt werden.
Neue diagnostische, prädiktive und prognostische Marker
Prädiktiver Wert einer p53-Mutation in adjuvanter Situation
Die CONKO-001-Studie setzte Standards in der adjuvanten Therapie des Pankreaskarzinoms. Auf dem diesjährigen ESMO wurden Daten zur Molekularpathologie des Patientenkollektivs demonstriert [37]. Die CONKO-Gruppe konnte zeigen, dass das Vorliegen einer p53-Mutation einen negativen Einfluss auf das krankheitsfreie Überleben in der Beobachtungsgruppe bedingte (HR 2,90). Im Umkehrschluss profitierten Patienten mit einer p53-Mutation signifikant von einer adjuvanten Therapie mit Gemcitabin (DFS 12,5 Monate versus 4,4 Monate).
“Die Daten der CONKO-Gruppe stellen die ersten „next generation sequencing“(NGS)-Daten dar, die im Rahmen einer prospektiven Studie zum Pankreaskarzinom gewonnen wurden. Die Daten zeigen, dass Strategien zur Therapiestratifizierung auch beim Pankreaskarzinom denkbar sind.“ Dr. med. C. Benedikt Westphalen
Rolle von „liquid biopsies“ beim Pankreaskarzinom
Zirkulierende Tumor-DNA, eine Form der sogenannten „liquid biopsies“, stellt eine attraktive Technik für die Diagnose und das Therapiemonitoring von Tumorerkrankungen dar [38]. Eine koreanische Gruppe präsentierte Daten aus einem gemischten Kollektiv von Patienten mit Pankreaskarzinom [39]. Es erfolgte die Messung von mutierten KRAS-Transkripten in der Zirkulation und die Korrelation mit Mutationen im Tumorgewebe. In der Gesamtpopulation zeigte sich, dass das Vorhandensein von zirkulierender Tumor-DNA mit einer schlechten Prognose verbunden war. Dieser Effekt wurde besonders bei Patienten im resektablen Stadium deutlich, bei denen die Präsenz (hoher Level) zirkulierender Tumor-DNA mit einem deutlich verkürzten krankheitsfreien Überleben einherging.
“Zirkulierende Tumor-DNA hat das Potenzial, ein wichtiges Werkzeug in der Therapiesteuerung und Risikoabschätzung zu werden. Eine Validierung innerhalb prospektiver Studien fehlt allerdings noch.“ Dr. med. C. Benedikt Westphalen
Fazit
- Neue, prospektiv validierte Biomarker für Patienten mit Pankreaskarzinom fehlen weiterhin.
- Der stromale Hyaluronsäuregehalt hat großes klinisches Potenzial.
- NGS-Analysen aus prospektiven klinischen Studien können relevante Erkenntnisse liefern.
- Zirkulierende Tumor-DNA könnte in Zukunft im Rahmen von Diagnose und Therapiesteuerung des Pankreaskarzinoms zum Einsatz kommen.
Quellen
- Garrido-Laguna I et al. Pancreatic cancer: from state-of-the-art treatments to promising novel therapies., in Nature Reviews Clinical Oncology 2015.
- Oberstein PE et al. Pancreatic cancer: why is it so hard to treat? Therapeutic advances in gastroenterology 2013; 6: 321-337.
- Rahib L et al. Projecting Cancer Incidence and Deaths to 2030: The Unexpected Burden of Thyroid, Liver, and Pancreas Cancers in the United States. Cancer Research 2014.
- Quante AS et al. Projections of cancer incidence and cancer-related deaths in Germany by 2020 and 2030., in Cancer Med 2016. p. 2649-2656.
- Conroy T et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med 2011; 364: 1817-1825.
- Von Hoff DD et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. The New England journal of medicine 2013; 369: 1691-1703.
- Neoptolemos JP et al. Comparison of adjuvant gemcitabine and capecitabine with gemcitabine monotherapy in patients with resected pancreatic cancer (ESPAC-4): a multicentre, open-label, randomised, phase 3 trial. Lancet 2017; 389: 1011-1024.
- Philip PA et al. nab-Paclitaxel (nab-P) plus gemcitabine (G) for patients (Pts) with locally advanced pancreatic cancer (LAPC): Interim efficacy and safety results from the Phase 2 LAPACT Trial. Presented at Poster Discussion session, ESMO 2017, Madrid, abstract 622PD.
- Portales F et al. Interim health related quality of life (QoL) from LAPACT, a Phase 2 trial of nab-paclitaxel (nab-P) plus gemcitabine (G) for patients (Pts) with locally advanced pancreatic cancer (LAPC). Poster Display session, ESMO 2017, Madrid, abstract 730P.
- Reni M et al. Randomized phase 2 trial of peri- or post-operative chemotherapy in resectable pancreatic adenocarcinoma. Presented at Poster Display session, ESMO 2017, Madrid, abstract 736P.
- Neesse A et al. CTGF antagonism with mAb FG-3019 enhances chemotherapy response without increasing drug delivery in murine ductal pancreas cancer. Proceedings of the National Academy of Sciences of the United States of America 2013.
- Carrier E et al. Anti-CTGF human recombinant monoclonal antibody pamrevlumab increases resectability and resection rate when combined with gemcitabine/Nab-paclitaxel in the treatment of locally advanced pancreatic cancer patients. Poster Discussion session, ESMO 2017, abtract 1734PD.
- Dueland S et al. TG01/GM-CSF and adjuvant gemcitabine in patients with resected RAS-mutant adenocarcinoma of the pancreas. Poster Display session, ESMO 2017, Madrid, abstract 669P.
- Neesse A et al. Stromal biology and therapy in pancreatic cancer: a changing paradigm. Gut 2015.
- Provenzano PP et al. Enzymatic targeting of the stroma ablates physical barriers to treatment of pancreatic ductal adenocarcinoma. Cancer Cell 2012; 21: 418-429.
- Jacobetz MA et al. Hyaluronan impairs vascular function and drug delivery in a mouse model of pancreatic cancer. Gut 2012.
- Hingorani S et al. Randomized phase 2 study of PEGPH20 Plus nab-paclitaxel/gemcitabine (PAG) vs AG in patients (Pts) with untreated, metastatic pancreatic ductal adenocarcinoma (mPDA). Poster Display session, ESMO 2017, Madrid, abstract 763P.
- Hendifar A et al. Tumor hyaluronan (HA) is a novel biomarker: Results of the randomized phase 2 HALO 202 study of PEGPH20 plus nab-paclitaxel/gemcitabine (PAG) vs AG in previously untreated, metastatic pancreatic ductal adenocarcinoma (mPDA). Poster Display session, ESMO 2017, Madrid, abstract 743P.
- Bullock A et al. Musculoskeletal Events (MSEs) with PEGPH20 treatment and management in patients with previously untreated metastatic pancreatic ductal adenocarcinoma (mPDA). Poster Display session, ESMO 2017, Madrid, abstract 749P.
- Reni M et al. Randomized phase 2 trial of nab-paclitaxel plus gemcitabine, ± capecitabine, cisplatin (PAXG regimen) in metastatic pancreatic adenocarcinoma. Poster Display session, ESMO 2017, Madrid, abstract 739P.
- Gracian AC et al. YOSEMITE: A 3 arm double-blind randomized phase 2 study of gemcitabine, paclitaxel protein-bound particles for injectable suspension, and placebo (GAP) versus gemcitabine, paclitaxel protein-bound particles for injectable suspension and either 1 or 2 truncated courses of demcizumab (GAD). Poster Discussion session, ESMO 2017, Madrid, abstract 620PD.
- Rhim AD et al. Stromal Elements Act to Restrain, Rather Than Support, Pancreatic Ductal Adenocarcinoma., in Cancer Cell 2014. dbfrom=pubmed&id=24856585&retmode=ref&cmd=prlinks
- Kim EJ et al. Pilot clinical trial of hedgehog pathway inhibitor GDC-0449 (vismodegib) in combination with gemcitabine in patients with metastatic pancreatic adenocarcinoma. Clin Cancer Res 2014; 20: 5937-5945.
- Lee K et al. A Phase I study of LDE225 in combination with gemcitabine and nab-paclitaxel in patients with metastasized pancreatic cancer. Poster Display session, ESMO 2017, Madrid, abstract 761P.
- Noel M et al. Phase Ib study of PF-04136309 (an oral CCR2 inhibitor) in combination with nab-paclitaxel/gemcitabine in first-line treatment of metastatic pancreatic adenocarcinoma. Poster Display session, ESMO 2017, Madrid, abstract 750P.
- Nywening TM et al. Targeting tumour-associated macrophages with CCR2 inhibition in combination with FOLFIRINOX in patients with borderline resectable and locally advanced pancreatic cancer: a single-centre, open-label, dose-finding, non-randomised, phase 1b trial., in Lancet Oncol 2016.
- Stupp R et al. Maintenance Therapy With Tumor-Treating Fields Plus Temozolomide vs Temozolomide Alone for Glioblastoma: A Randomized Clinical Trial. JAMA 2015; 314: 2535-2543.
- Stupp R et al. NovoTTF-100A versus physician's choice chemotherapy in recurrent glioblastoma: a randomised phase III trial of a novel treatment modality. Eur J Cancer 2012; 48: 2192-2202.
- Kueng M et al. PANOVA: a phase II study of TTFields (150 kHz) with concomitant standard chemotherapy for front-line advanced pancreatic adenocarcinoma: Updated efficacy results. Presented at Poster Display session, ESMO 2017, Madrid, abstract 759P.
- Farber O et al. PANOVA-3: A phase 3 study of TTFields with gemcitabine and nab-paclitaxel for front-line treatment of locally-advanced pancreatic adenocarcinoma (LAPC). Poster Display session, ESMO 2017, Madrid, abstract 782TiP.
- Hecht J et al. Overall survival and immunologic responses in metastatic pancreatic adenocarcinoma (PDAC) on PEGylated human IL-10 (AM0010) with 5-FU/LV and oxaliplatin (FOLFOX). Poster Display session, ESMO 2017, Madrid, abstract 744P.
- Alistar AT et al. New promising combination therapy of a mitochondrial metabolism inhibitor with mFOLFIRINOX in pancreatic cancer. Poster Discussion session, ESMO 2017, Madrid, abstract 1733PD.
- Hammel P et al. A Phase 2b of eryaspase in combination with gemcitabine or FOLFOX as second-line therapy in patients with metastatic pancreatic adenocarcinoma (NCT02195180). Presented at Poster Discussion session, ESMO 2017, Madrid, abstract 621PD.
- Papneja N et al. Comparisons of outcomes of patients with advanced pancreatic cancer (APC) treated with FOLFIRINOX (FX) versus gemcitabine and nab-paclitaxel (GN): A population-based cohort study. Poster Display session, ESMO 2017, Madrid, abstract 748P.
- Al-Batran S et al. Metastatic pancreatic cancer: Real Life data from the german quality of life and translational research on pancreatic cancer study (QoliXane). Poster Display session, ESMO 2017, Madrid, abstract 751P.
- Hidalgo M et al. A phase I and randomized phase II trial to evaluate the efficacy and safety of nab-paclitaxel (nab-P) in combination with gemcitabine (G) for the treatment of patients with ECOG 2 advanced pancreatic cancer (PDAC). Poster Discussion session, ESMO 2017, Madrid, abstract 623PD.
- Sinn M et al. TP53 mutation predicts sensitivity to adjuvant gemcitabine in pancreatic cancer: Results from the CONKO-001 study. Poster Display session, ESMO 2017, Madrid, abstract 737P.
- Wan JC et al. Liquid biopsies come of age: towards implementation of circulating tumour DNA. Nat Rev Cancer 2017; 17: 223-238.
- Kim M et al. Prognostic impact of KRAS mutation in cell-free DNA in patients with pancreatic cancer. Poster Display session, ESMO 2017, Madrid, abstract 32P.
- Bildnachweis: „Palacio Real de Madrid”: © krivinis/Fotolia; „Plaza de Cibeles mit dem Brunnen und Palast Cibeles in Madrid”: © FSEID/Fotolia
Mammakarzinom – Zwischen Eskalation und Deeskalation: Ergebnisse vom Europäischen Krebskongress 2017 in Madrid
Prof. Dr. med. Cornelia Liedtke, Gynäkologie mit Brustzentrum, Charité-Universitätsklinikum Berlin
 Auch auf dem diesjährigen Kongress der European Society for Medical Oncology (ESMO) wurden zahlreiche interessante Studienergebnisse präsentiert. Dabei ist grundsätzlich zu erkennen, dass der ESMO als Gegenstück zum Kongress der American Society of Clinical Oncology (ASCO) zunehmend an Bedeutung gewinnt. So wurden auch aus großen zulassungsrelevanten Studien erste Daten präsentiert.
Auch auf dem diesjährigen Kongress der European Society for Medical Oncology (ESMO) wurden zahlreiche interessante Studienergebnisse präsentiert. Dabei ist grundsätzlich zu erkennen, dass der ESMO als Gegenstück zum Kongress der American Society of Clinical Oncology (ASCO) zunehmend an Bedeutung gewinnt. So wurden auch aus großen zulassungsrelevanten Studien erste Daten präsentiert.
(Neo-)adjuvante Behandlung
Eskalation der endokrinen Therapie durch die Hinzunahme von Fulvestrant?
Die endokrine Therapie ist wichtiger Bestandteil der Therapie des hormonrezeptorpositiven Mammakarzinoms sowohl im kurativen als auch im palliativen Setting. Dabei steht der zunehmenden Eskalation der endokrinen Therapie der Versuch der Deeskalation der Chemotherapie gegenüber.
In diesem Zusammenhang sind die Ergebnisse der GEICAM/200610-Studie zu sehen, in der versucht wurde, den „selektiven Östrogenrezeptor-Downregulator“ Fulvestrant als Bestandteil der endokrinen Therapie des frühen Mammakarzinoms zu etablieren [1]. In dieser Studie wurde die Hypothese verfolgt, dass der Einsatz von Fulvestrant in Kombination mit dem Aromatasehemmer Anastrozol die Entwicklung einer endokrinen Resistenz verhindern/verzögern könne. Daten von 2716 Patientinnen wurden ausgewertet, die entweder über fünf Jahre mit Anastrozol oder über drei Jahre mit Anastrozol+Fulvestrant gefolgt von zwei Jahren Anastrozol behandelt worden waren. Es zeigte sich keine statistisch signifikante Verbesserung des erkrankungsfreien Überlebens (disease free survival, DFS) durch die Hinzunahme von Fulvestrant. Der Anteil an Patientinnen ohne Erkrankung nach fünf Jahren betrug in der Gruppe mit Monotherapie 90,77% und in der Gruppe mit Kombinationstherapie 91,25% (p = 0,357). Offenbar ist auch im adjuvanten Setting die Kombination aus einem Aromatasehemmer und Fulvestrant – ähnlich wie im metastasierten Setting – der alleinigen Aromatasehemmertherapie nicht signifikant überlegen.
Duale Blockade des HER2-positiven Mammakarzinoms durch Neratinib
Daten zur Eskalation der HER2-zielgerichteten Therapie des HER2-positiven Mammakarzinoms im kurativen Setting sind heterogen. In der ALTTO-Studie konnte die Hinzunahme von Lapatinib das DFS der eingeschlossenen Patientinnen nicht signifikant verbessern [2]. In der APHINITY-Studie zeigte sich durch die Hinzunahme von Pertuzumab zwar eine statistisch signifikante Verbesserung des DFS, diese war aber mit einer absoluten Zunahme von einem Prozent und einer „number needed to treat“ von 112 nur grenzwertig klinisch relevant [3]. In diesem Zusammenhang sind die Daten der placebokontrollierten ExteNET-Studie zu sehen [4]. In dieser Phase-III-Studie wurde eine sequentielle HER2-Blockade durchgeführt, indem Neratinib als irreversibler Blocker von HER1/2/4 nach abgeschlossener Trastuzumabtherapie eingesetzt wurde (siehe Abb. 1).
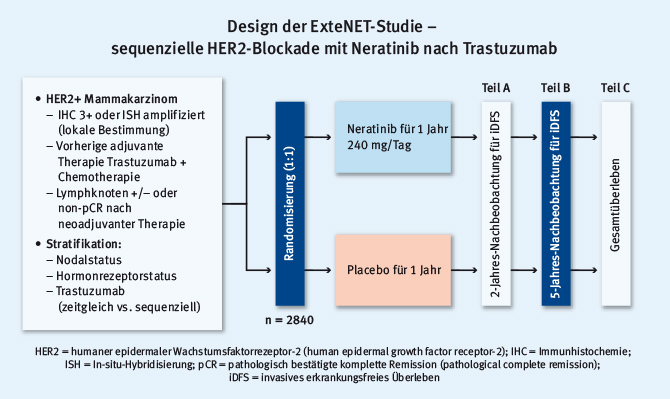 Abb. 1: Design der ExteNET-Studie zur sequenziellen HER2-Blockade durch Neratinib nach abgeschlossener Trastuzumabtherapie (modifiziert nach [4])
Abb. 1: Design der ExteNET-Studie zur sequenziellen HER2-Blockade durch Neratinib nach abgeschlossener Trastuzumabtherapie (modifiziert nach [4])Der primäre Studienendpunkt umfasste das invasive DFS. Bereits die früheren Untersuchungen hatten einen Vorteil durch die Hinzunahme von Neratinib belegt. Dieser Vorteil wurde in der aktuellen 5-Jahresanalyse bestätigt. Es zeigte sich ein absoluter Vorteil von 2,5% in der Intent-to-treat-Population (Hazard Ratio [HR] 0,73; P = 0,008) sowie ein absoluter Benefit von 4,4% in der hormonrezeptorpositiven Kohorte (HR = 0,60; P = 0,002; siehe Abb. 2). Gesamtüberlebensdaten werden für 2019 erwartet.
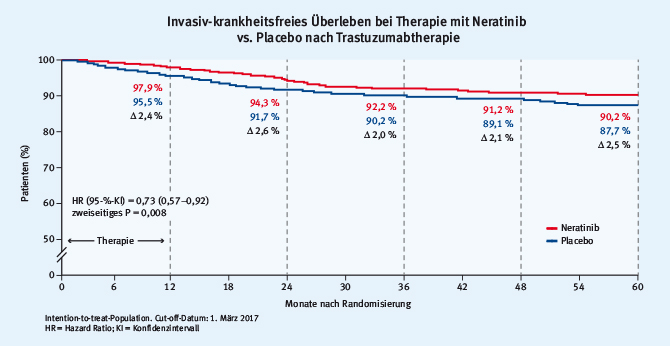 Abb. 2: Ergebnisse der ExteNET-Studie, Vergleich des invasiv-krankheitsfreien Überlebens bei sequenzieller HER2-Blockade durch Neratinib versus Placebo nach abgeschlossener Trastuzumabtherapie (modifiziert nach [4])
Abb. 2: Ergebnisse der ExteNET-Studie, Vergleich des invasiv-krankheitsfreien Überlebens bei sequenzieller HER2-Blockade durch Neratinib versus Placebo nach abgeschlossener Trastuzumabtherapie (modifiziert nach [4])Carboplatin-haltige Chemotherapie
In der Therapie des frühen tripelnegativen Mammakarzinoms (TNBC) hat Carboplatin in zwei unabhängigen neoadjuvanten Studien die Raten pathologisch kompletter Remission (pathologic complete remission, pCR) signifikant verbessert. Beim diesjährigen ESMO wurden die Überlebensraten (durchschnittlich 47,3 Monate) der Gepar-Sixto-Studie (Paclitaxel+Myocet+Carboplatin [PMCb] vs. Paclitaxel+Myocet [PM]) nach verlängerter Nachbeobachtungszeit gezeigt [5]. Die zuvor beobachtete Verbesserung des DFS wurde auch in der aktuellen Analyse bestätigt (siehe Tab. 1).
 Tab. 1: Ergebnisse der Gepar-Sixto-Studie zur Hinzunahme von Carboplatin in die neoadjuvante Therapie (modifiziert nach [5])
Tab. 1: Ergebnisse der Gepar-Sixto-Studie zur Hinzunahme von Carboplatin in die neoadjuvante Therapie (modifiziert nach [5])Einsatz von genomischen Tests
Durch den adäquaten Einsatz genomischer Tests kann die Prognose von Patientinnen mit hormonrezeptorpositiver Erkrankung im kurativen Setting vorhergesagt und möglicherweise die Frequenz adjuvanter Chemotherapien gesenkt werden. Gluz et al. zeigten in diesem Zusammenhang die Daten zur erweiterten Nachbeobachtung der WSG-planB-Studie [6]. Die planB-Studie ist eine prospektiv-randomisierte Studie zur Evaluation von 6 x Docetaxel+Cyclophosphamid vs. 4 x Epirubicin+Cyclophosphamid gefolgt von 4 x Docetaxel sowie dem Einsatz des Recurrence-Score (RS, Oncotype Dx) zur Indikation der Chemotherapie per se (siehe Abb. 3).
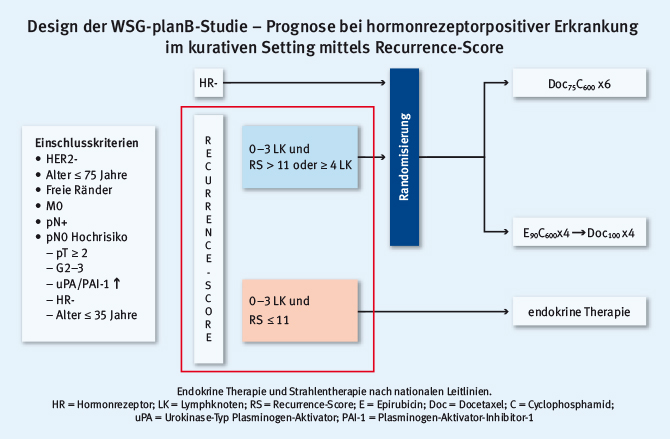 Abb. 3: Design der planB-Studie zur Evaluation einer adjuvanten Therapie mit Docetaxel+Cyclophosphamid vs. Epirubicin+Cyclophosphamid gefolgt von Docetaxel und zur Evaluation des Recurrence-Scores als Indikation zur adjuvanten Chemotherapie (modifiziert nach [6])
Abb. 3: Design der planB-Studie zur Evaluation einer adjuvanten Therapie mit Docetaxel+Cyclophosphamid vs. Epirubicin+Cyclophosphamid gefolgt von Docetaxel und zur Evaluation des Recurrence-Scores als Indikation zur adjuvanten Chemotherapie (modifiziert nach [6])Abb. 4 zeigt die exzellente Prognose der Patientinnen mit einem RS von weniger als elf. Die Daten der planB-Studie stellen die therapeutische Deeskalation für Patientinnen mit einem nodalnegativen und nodalpositiven Mammakarzinom (1–3 positive Lymphknoten) in Aussicht.
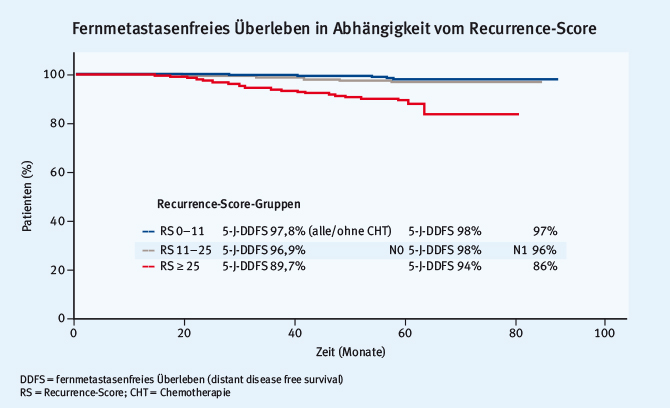 Abb. 4: Ergebnisse der planB-Studie, fernmetastasenfreies Überleben abhängig vom Recurrence-Score (modifiziert nach [6])
Abb. 4: Ergebnisse der planB-Studie, fernmetastasenfreies Überleben abhängig vom Recurrence-Score (modifiziert nach [6])Immuntherapie
Aufgrund seiner im Vergleich zu anderen Mammakarzinomsubtypen höheren Mutationsrate ist das TNBC mehr als andere Subtypen geeignet für eine Therapie mit Immunonkologika wie beispielsweise Checkpointinhibitoren. In diesem Zusammenhang wurde im Rahmen des diesjährigen ESMO das Design der laufenden KEYNOTE-522-Studie vorgestellt [7]. In dieser Studie werden Patientinnen (n = 855) mit tripelnegativem Mammakarzinom (T1c N1-2, T2-4 N0-2) randomisiert zu einer neoadjuvanten Chemotherapie mit vs. ohne Pembrolizumab. Die entsprechende Therapie (Pembrolizumab vs. Placebo) wird dann adjuvant noch über neun Zyklen fortgesetzt. Die co-primären Endpunkte der Studie umfassen die pCR-Rate sowie das ereignisfreie Überleben (event-free survival, EFS). Bei den sekundären Studienendpunkten handelt es sich um diese beiden Endpunkte in Abhängigkeit der Expression von PD-L1 (programmed death ligand-1).
Dass die Expression von PD-L1 beziehungsweise die unspezifische Aktivierung des Immunsystems – wie beispielsweise beim Vorkommen von tumorinfiltrierenden Lymphozyten (TILs) – relevant sein könnte, zeigen die Ergebnisse der korrelativen Analysen der KEYNOTE-086-Studie, die beim diesjährigen ESMO von Sherene Loi vorgestellt wurden [8]. Dabei zeigte sich eine signifikant höhere Expression von TILs bei Patientinnen ohne vorangegangene Systemtherapie (Kohorte B, alle PD-L1-positiv, 17,5%) im Vergleich zu Patientinnen, die in metastasierten Stadien schon mindestens eine Chemotherapie erhalten hatten (Kohorte A, PD-L1-positiv und ‑negativ, 5%). In der Gruppe der therapienaiven, PD-L1-positiven Tumore zeigten sich signifikant höhere Ansprechraten. Auch zeigte sich eine Korrelation zwischen TILs und Ansprechen auf Pembrolizumab (Odds Ratio 1,26; p = 0,01). Diese Daten zeigen, dass sich anhand des immunzellulären Infiltrats beziehungsweise anhand der PD-L1-Expression eine erhöhte Wahrscheinlichkeit für das Ansprechen auf Pembrolizumab ableiten lässt [8].
Fazit
- Der Versuch einer Eskalation der adjuvanten endokrinen Therapie durch die Hinzunahme von Fulvestrant zu einer Aromatasehemmertherapie führt nicht zu einer Verbesserung der Prognose von Patientinnen mit hormonrezeptorpositivem Mammakarzinom.
- Es ist bislang nicht abzusehen, wie die adjuvante HER2-zielgerichtete Therapie der Zukunft aussehen wird. Hier wird eine adäquate Risikostratifikation besonders wichtig sein.
- Der neoadjuvante Einsatz der Chemotherapie, wie er beispielsweise in den Empfehlungen der Arbeitsgemeinschaft Gynäkologische Onkologie (AGO) Kommission Mamma für Patientinnen mit tripelnegativem Mammakarzinom empfohlen [9] wird, wird auch durch die Ergebnisse der verlängerten Nachbeobachtungszeit der Gepar-Sixto-Studie bestätigt. Angesichts der vorhandenen Wahrscheinlichkeit für frühe Rezidive, die sich bei tripelnegativen Tumoren beobachten lässt, muss die mittlere Nachbeobachtungzeit von knapp 50 Monaten als ausreichend angesehen werden.
- Die Vorhersage des Rezidivrisikos mittels Oncotype Dx ist zuverlässig.
- Immuntherapien scheinen bei einigen Patientinnen mit tripelnegativem Mammakarzinom wirksam zu sein. Die Bestimmung von TILs bzw. der Expression von PD-L1 könnte helfen, diese Patientinnen zu identifizieren.
„Die größte klinisch-wissenschaftliche Herausforderung in der adjuvanten Therapie des Mammakarzinoms liegt in der Differenzierung jener Patientinnen, die einer Therapieeskalation bedürfen, und jener Patientinnen, die aufgrund guter Prognose und hoher Therapieempfindlichkeit eine Deeskalation ihrer Therapie erfahren können.“ Prof. Dr. med. Cornelia Liedtke
Fortgeschrittenes bzw. metastasiertes Mammakarzinom
Immuntherapie auf Abwegen – Einsatz in Kombination mit lokaler Strahlentherapie
Der Umfang an Studien, bei denen eine Immuncheckpointblockade eingesetzt wird, ist bei Patientinnen mit metastasierter Erkrankung bereits deutlich höher.
Dabei kristallisieren sich einige neue, interessante Konzepte heraus, bei denen Immunonkologika vor dem Hintergrund ihres alternativen Wirkmechanismus eingesetzt werden. In einer kleinen Studie wurde beispielsweise der PD1(programmed cell death receptor-1)-Inhibitor Pembrolizumab bei Patientinnen mit metastasiertem TNBC eingesetzt. Dahinter steht die Vorstellung, dass durch die lokale Zerstörung von Tumorzellen distante immunologische Phänomene ausgelöst werden könnten, die wiederum die Wirksamkeit der Immuntherapie erhöhen könnten. In die Untersuchung wurden 17 Patientinnen eingeschlossen, die zum Teil bereits mehrere Vortherapien erhalten hatten. Von diesen Patientinnen waren letztlich nur sechs auswertbar. Hier zeigten sich zwei partielle Remissionen, eine Patientin mit stabiler Situation und drei Patientinnen mit einem Progress der Erkrankung. Die Nebenwirkungen umfassten weitestgehend Fatigue und Übelkeit [10]. Auch wenn diese Studie nur sehr klein war, zeigt sie doch, dass die neuen Immunonkologika auch im Zusammenhang mit alternativen (und auch vielversprechenden) Therapieansätzen zum Einsatz kommen könnten.
Ergebnisse nicht-interventioneller Studien zum Einsatz von nab-Paclitaxel beim metastasierten Mammakarzinom
Nab-Paclitaxel ist fester Bestandteil der Therapie des metastasierten Mammakarzinoms und wird in den verfügbaren Handlungsalgorithmen neben Docetaxel und konventionellem Paclitaxel als wirksames Taxan eingesetzt [11].
In der NABUCCO-Studie wurde der Einfluss einer nab-Paclitaxeltherapie auf die Lebensqualität von Patientinnen mit metastasiertem Mammakarzinom untersucht. In diese nicht-interventionelle Studie (NIS) wurden 697 Patientinnen an 128 deutschen Zentren eingeschlossen [12]. Es zeigte sich ein medianes Gesamtüberleben von 15,6 Monaten, welches umso schlechter war, je mehr Vortherapien gegeben worden waren (OS bei Vorbehandlung mit Taxanen 13,7 Monate vs. 18,3 Monate ohne Vorbehandlung mit Taxanen). Die Nebenwirkungen umfassten das übliche Toxizitätsspektrum, welches auch sonst mit nab-Paclitaxel in Verbindung gebracht wird. Diese Nebenwirkungen führten jedoch nicht zu einer Abnahme der Lebensqualität.
Ähnliche Ergebnisse zeigte auch die GIM3-AMBRA-Studie, die als longitudinale Kohortenstudie ebenfalls “real-life”-Daten zum Einsatz von nab-Paclitaxel aus dem metastasierten Setting lieferte [13]. Die Autoren berichteten über vorläufige Ergebnisse nach Behandlung der ersten 791 von insgesamt 1.500 geplanten Patientinnen. Der überwiegende Anteil der Patientinnen wurde mit dem dreiwöchigen Regime behandelt (47,7%), nur etwa ein Viertel der Patientinnen erhielt die wöchentliche Therapie (28%). Patientinnen wurden durchschnittlich mit fünf Zyklen behandelt und die Anzahl der Zyklen variierte nicht in Abhängigkeit des verwendeten Regimes.
Einfluss des höheren Lebensalters auf die Rate palliativer Chemotherapien
Es ist bekannt, dass die Wahrscheinlichkeit der Empfehlung einer Chemotherapie mit steigendem Alter der Patientin abnimmt. Bei Patientinnen mit tripelnegativem Mammakarzinom jedoch stellt die Chemotherapie die einzige systemische Therapie dar. Satram-Hoang et al. untersuchten Behandlungsschemata und -ergebnisse bei Patientinnen mit metastasiertem tripelnegativen Mammakarzinom im Alter von mindestens 66 Jahren [14]. In der endgültigen Patientinnenpopulation lag das Durchschnittsalter bei 77,6 Jahren. Nur 48 Prozent (n = 1.259) der Patientinnen erhielten eine Chemotherapie. Die Wahrscheinlichkeit einer Chemotherapie war signifikant höher bei Patientinnen unter 70 Jahren (66%) im Vergleich zu Patientinnen ab 70 Jahren (45%). Die Durchführung einer Chemotherapie resultierte in einem signifikant besseren Gesamtüberleben. Diese Studie befasst sich mit dem Risiko einer Untertherapie bei älteren Patientinnen mit TNBC und der daraus resultierenden Möglichkeit einer schlechteren Prognose. Studien sollten Patientinnen höheren Lebensalters gezielt einschließen.
In einer anderen Studie wurde die allgemeine Behandlungsrealität bei Patientinnen mit tripelnegativem Mammakarzinom untersucht. Es zeigte sich bei der Analyse von 411 Patientinnen aus den USA, dass hier zwar eine Vielzahl an klassischen Chemotherapien appliziert wurde, das resultierende mediane Gesamtüberleben jedoch lediglich bei 16,7 beziehungsweise 14,2 Monaten in der Erst- bzw. Zweitliniensituation lag [15]. Diese Daten betonen noch einmal die Notwendigkeit der Entwicklung neuer zielgerichteter Substanzen für das TNBC sowie die Notwendigkeit der molekularen Klassifikation dieser als sehr heterogen anerkannten Entität.
Neues zur CDK-4/6-Inhibition des hormonrezeptorpositiven Mammakarzinoms
Nicht zuletzt durch die Einführung der CDK-4/6-Inhibitoren und die daraus resultierende Möglichkeit, endokrine Resistenzen zu unterbinden, hat sich die Therapierbarkeit des (metastasierten) hormonrezeptorpositiven Mammakarzinoms deutlich verbessert. Die drei derzeit in Studien untersuchten CDK-4/6-Inhibitoren zeigen ein ähnliches Wirksamkeitsspektrum, bei Heterogenität hinsichtlich der beobachteten Toxizitäten.
Im Rahmen des diesjährigen ESMO wurden die Daten der MONARCH-3-Studie vorgestellt. Deren Ergebnisse wurden im Rahmen der Presidential Session von Angelo Di Leo präsentiert [16]. In der MONARCH-3-Studie wurden 493 Patientinnen in der Erstliniensituation zu einer endokrinen Therapie mit Letrozol mit Abemaciclib vs. Letrozol mit Placebo randomisiert. Die Daten dieser Studie wurden vorzeitig ausgewertet, ehe das mediane PFS im Therapiearm erreicht werden konnte; im Vergleichsarm lag das mediane PFS bei ca. 14 Monaten. Die Therapie mit Abemaciclib resultierte in einer signifikanten Verbesserung des medianen PFS mit einer Hazard Ratio von 0,54 (p = 0,000021). Wie schon anhand der Ergebnisse der vorangegangenen Studie zu vermuten, lag der Schwerpunkt der Nebenwirkungen neben der Hämatotoxizität, die einen Klasseneffekt der CDK-4/6-Inhibition darstellt, bei Diarrhoe. Auch weitere Subgruppenanalysen und Ergebnisse verschiedener Überlebensendpunkte der MONALEESA-2-Studie belegen die gute Wirksamkeit von CDK4/6-Inhibition (in diesem Fall Ribociclib) beim metastasierten Mammakarzinom [17].
Fazit
- Durch den Einsatz von Immunonkologika in Kombination mit lokalablativen Therapieverfahren könnte die Wirksamkeit von Immunonkologika verbessert werden.
- Nab-Paclitaxel zeigt in nicht-interventionellen Studien gute Wirksamkeit und insbesondere gute Verträglichkeit.
- Patientinnen, die im höheren Alter an einem tripelnegativen Mammakarzinom erkranken, sind dem Risiko einer signifikanten Untertherapie ausgesetzt.
- Die verfügbaren Daten zum Einsatz von CDK-4/6-Inhibitoren beim hormonrezeptorpositiven Mammakarzinom belegen die gute Wirksamkeit der Substanzen. Unterschiede zeigen sich hinsichtlich des Nebenwirkungsspektrums. Unklar ist bislang, nach welchen Kriterien die Entscheidung für oder wider einen spezifischen CDK-4/6-Inhibitor getroffen werden sollte.
„In meinen Augen ist die Entwicklung und Etablierung von endokrinen Therapien mit CDK-4/6-Blockade einer der großen Erfolge der letzten Jahre. Durch den Einsatz der Ciclibe kann die Frequenz palliativer Chemotherapien gesenkt und Lebensqualität gesteigert werden.“ Prof. Dr. med. Cornelia Liedtke
Neue Therapien
Durch die erhöhte Wahrscheinlichkeit, dass bei Patientinnen mit TNBC BRCA-Mutationen vorliegen, ist die Erkrankung in den Fokus von Studien zur Inhibition der Poly(ADP-Ribose)-Polymerase (PARP) gekommen. Diese Studien haben bislang heterogene Ergebnisse gezeigt, welche zum Teil auf die unterschiedliche Potenz der einzelnen PARP-Inhibitoren zurückgeführt werden kann [18]. Alternative DNA-Reparaturmechanismen umfassen das Protein ATR, welches für die Reparatur von DNA-Einzelstrangbrüchen verantwortlich ist. Melinda Telli stellte auf dem ESMO 2017 die Ergebnisse einer kleinen Phase-I-Studie vor, die den Einsatz des ATR-Inhibitors M6620 in Kombination mit Cisplatin bei Patientinnen mit zum Teil deutlich vorbehandelten Erkrankungen untersuchte [19]. In dieser Studie bei 35 Patientinnen mit zum Teil mehreren Chemotherapielinien im Vorfeld zeigte sich eine Gesamtansprechrate von ca. 40%.
Auch wenn sich die Prognose des HER2-positiven Mammakarzinoms durch die Vielzahl verfügbarer HER2-zielgerichteter Substanzen (Trastuzumab, Pertuzumab, Lapatinib und TDM-1) deutlich verbessert hat, erleiden immer noch die meisten Patienten mit metastasierter HER2-positiver Erkrankung einen Progress. Auf dem diesjährigen ESMO wurde eine weitere gegen HER2-zielgerichtete Substanz untersucht. Poziotinib ist ein neuartiger, oraler pan-HER-Kinaseinhibitor, der in Vorstudien durch eine irreversible Hemmung von Tyrosinkinasen deutliche antitumorale Effektivität gezeigt hat [20]. Insgesamt wurden 106 Patientinnen mit einem medianen Alter von 50 Jahren und einer medianen Anzahl von vier Vortherapien eingeschlossen. Das mediane PFS in diesem vorbehandelten Kollektiv lag bei ca. vier Monaten. Die Erkrankungskontrollrate lag bei 75,49%. Die häufigsten Nebenwirkungen umfassten Diarrhoe (96,23%), Stomatitis (92,45%) und Ausschlag (63,21%).
Fazit
- Die Hemmung von ATR könnte einen weiteren Therapieansatz beim tripelnegativen Mammakarzinom darstellen.
- Die Wirksamkeit von Poziotinib bei schwer vorbehandeltem HER2-positiven metastasierten Mammakarzinom entspricht derjenigen anderer Substanzen in dieser Indikation.
„Auch wenn die Prognose verschiedener Mammakarzinomsubgruppen mittlerweile exzellent ist, erleidet eine signifikante Anzahl an Patientinnen dennoch Rezidive und verstirbt an den Folgen der Erkrankung. Daher sollte die Entwicklung neuer Substanzen ein wichtiges Ziel bleiben.“ Prof. Dr. med. Cornelia Liedtke
Quellen
- Ruíz-Borrego M et al. Phase III evaluating the addition of fulvestrant (F) to anastrozol (A) as adjuvant therapy in postmenopausal women with hormone receptor positive HER2 negative (HR+/HER2-) early breast cancer (EBC): Results from the GEICAM/2006-10 study. Proffered Paper session, ESMO Congress 2017, Madrid, abstract 148O.
- Piccart-Gebhart M et al. Adjuvant Lapatinib and Trastuzumab for Early Human Epidermal Growth Factor Receptor 2-Positive Breast Cancer: Results From the Randomized Phase III Adjuvant Lapatinib and/or Trastuzumab Treatment Optimization Trial. J Clin Oncol 2016; 34: 1034-1042.
- Minckwitz GV et al. APHINITY trial (BIG 4-11): A randomized comparison of chemotherapy (C) plus trastuzumab (T) plus placebo (Pla) versus chemotherapy plus trastuzumab (T) plus pertuzumab (P) as adjuvant therapy in patients (pts) with HER2-positive early breast cancer (EBC). J Clin Oncol 35, 2017 (suppl; abstr LBA500).
- Jimenez MM et al. Neratinib after trastuzumab (T)-based adjuvant therapy in early-stage HER2+ breast cancer (BC): 5-year analysis of the phase III ExteNET trial. Proffered Paper session, ESMO 2017, Madrid, abstract 149O.
- Untch M et al. Long-term survival analysis of the randomized phase II trial investigating the addition of carboplatin to neoadjuvant therapy for triple-negative (TNBC) and HER2-positive early breast cancer (GeparSixto). Poster Discussion session, ESMO 2017, Madrid, abstract 163PD.
- Gluz O et al. Prognostic impact of recurrence score (RS), grade/Ki67 central pathological review, and acycline (A)-free vs. A-containing chemotherapy (CT) on distant and locoregional disease-free survival (DDFS/LRFS) in high clinical risk HER2- early breast cancer (EBC): WSG PlanB trial results. Poster Discussion session, ESMO 2017, Madrid, abstract LBA11.
- Schmid P et al. KEYNOTE-522: Phase III study of pembrolizumab (pembro) + chemotherapy (chemo) vs placebo + chemo as neoadjuvant followed by pembro vs placebo as adjuvant therapy for triple-negative breast cancer (TNBC). Poster Display session, ESMO 2017, Madrid, abstract 233TiP.
- Loi S et al. Relationship between tumor infiltrating lymphocyte (TIL) levels and response to pembrolizumab (pembro) in metastatic triple-negative breast cancer (mTNBC): Results from KEYNOTE-086. Proffered Paper session, ESMO 2017, Madrid, abstract LBA13.
- Liedtke C et al. AGO Recommendations for the Diagnosis and Treatment of Patients with Early Breast Cancer: Update 2017. Breast Care (Basel) 2017; 12: 172-183.
- McArthur HL et al. A single-arm, phase ii study assessing the efficacy of pembrolizumab (pembro) plus radiotherapy (RT) in metastatic triple negative breast cancer (mTNBC). Poster Display session, ESMO 2017, Madrid, abstract 247P.
- Thill M et al. AGO Recommendations for the Diagnosis and Treatment of Patients with Advanced and Metastatic Breast Cancer: Update 2017. Breast Care (Basel) 2017; 12: 184-191.
- Potthoff K et al. Overall survival and quality of life in patients with metastatic breast cancer treated with nab-paclitaxel: Final results of the non-interventional study NABUCCO. Poster Display session, ESMO 2017, Madrid, abstract 293P.
- Mustacchi G et al. Nab-paclitaxel (Nab-P) in HER2-ve advanced breast cancer (ABC) patients (pts): From randomized trials to real-life setting: Results from GIM13 - AMBRA study. Poster Display session, ESMO 2017, Madrid, abstract 309P.
- Satram-Hoang S et al. Real-world treatment patterns and outcomes among elderly metastatic triple negative breast cancer patients in the United States. Poster Display session, ESMO 2017, Madrid, abstract 277P.
- Bajaj P et al. What are the treatment patterns and overall survival (OS) in patients with metastatic triple-negative breast cancer (mTNBC) in US clinical practice? Poster Display session, ESMO 2017, Madrid, abstract 268P.
- Leo AD et al. MONARCH 3: Abemaciclib as initial therapy for patients with HR+/HER2- advanced breast cancer. Presented at Presidential Symposium II, ESMO 2017, Madrid, abstract 2360_PR.
- Janni W et al. Duration of response and tumor shrinkage with first-line ribociclib + letrozole in postmenopausal women with HR+, HER2– ABC. Poster Discussion session, ESMO 2017, Madrid, abstract 245PD.
- Lord CJ et al. PARP inhibitors: Synthetic lethality in the clinic. Science 2017; 355: 1152-1158.
- Telli ML et al. Initial results of a phase 1 dose expansion cohort of M6620 (formerly VX-970), an ATR inhibitor, in combination with cisplatin in patients with advanced triple-negative breast cancer NCT02157792). Poster Discussion session, ESMO 2017, Madrid, abstract 242PD.
- Park Y et al. A phase II trial of pan-HER inhibitor Poziotinib, in patients with HER2-positive metastatic breast cancer who have received at least two prior HER2-directed regimens: The results of NOV120101-203 trial. Proffered Paper session, ESMO 2017, Madrid, abstract 237O.
- Bildnachweis: "Puerta de Alcala in Madrid, Spain": © ekaterina_belova/Fotolia
Nicht-kleinzelliges Lungenkarzinom (NSCLC) – Highlights vom ESMO-Kongress 2017
Dr. med. Jürgen Alt, III. Medizinische Klinik und Poliklinik und Universitäres Tumorcentrum (UCT), Mainz
 Auch der diesjährige Kongress der European Society for Medical Oncology (ESMO) musste sich nicht hinter seinem großen amerikanischen Bruder verstecken. Auf dem Gebiet der Immuntherapie und der zielgerichteten Therapie wurden erneut herausragende Ergebnisse präsentiert, die das Potenzial haben, die bisherige klinische Praxis zu verändern.
Auch der diesjährige Kongress der European Society for Medical Oncology (ESMO) musste sich nicht hinter seinem großen amerikanischen Bruder verstecken. Auf dem Gebiet der Immuntherapie und der zielgerichteten Therapie wurden erneut herausragende Ergebnisse präsentiert, die das Potenzial haben, die bisherige klinische Praxis zu verändern.
Immuntherapie
Die bedeutendsten Ergebnisse wurden von Luis Paz-Ares als Late Breaking Abstract Nr. 1 im Presidential Symposium präsentiert und von einer Publikation im New England Journal of Medicine begleitet [1, 2]. In der sogenannten PACIFIC-Studie wurde der Stellenwert einer konsolidierenden Immuntherapie mit dem gegen PD-L1 (programmed death ligand-1) gerichteten Antikörper Durvalumab bei Patienten mit lokal fortgeschrittenem nicht-kleinzelligem Lungenkarzinom (NSCLC) im Stadium III nach vorangegangener simultaner Radiochemotherapie geprüft. In dieser Phase-III-Studie wurden über 700 Patienten im Verhältnis 2:1 einer einjährigen Durvalumab-Therapie oder einem Placebo zugewiesen. Die präsentierte Zwischenanalyse konzentrierte sich auf das progressionsfreie Überleben (PFS); Daten zum co-primären Endpunkt des Gesamtüberlebens (OS) lagen noch nicht vor. Es zeigte sich ein markanter, hoch signifikanter Unterschied im medianen PFS von 16,8 versus 5,6 Monaten zugunsten der Immuntherapie (Abb. 1).
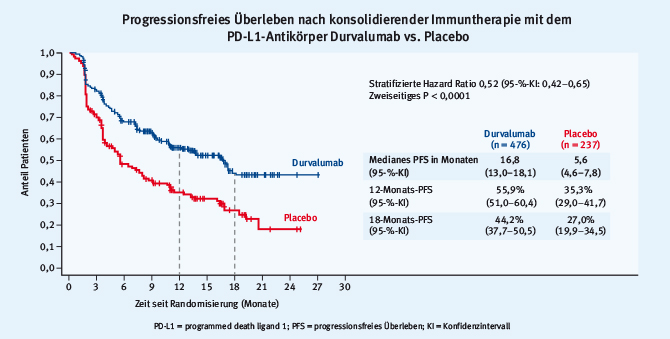 Abb. 1: Progressionsfreies Überleben von Patienten mit NSCLC im Stadium III nach simultaner Radiochemotherapie mit oder ohne konsolidierende Immuntherapie mit Durvalumab (modifiziert nach [1])
Abb. 1: Progressionsfreies Überleben von Patienten mit NSCLC im Stadium III nach simultaner Radiochemotherapie mit oder ohne konsolidierende Immuntherapie mit Durvalumab (modifiziert nach [1])Der Vorteil wurde in allen präspezifizierten Subgruppen beobachtet. Auch die mediane Zeit bis zum Auftreten von Fernmetastasen oder dem Versterben des Patienten wurde durch die Immuntherapie signifikant verlängert (23,2 gegenüber 14,6 Monaten). Die Rate an Grad-3/4-Toxizitäten war gegenüber der Placebobehandlung nur moderat erhöht und entsprach hinsichtlich Frequenz und Spektrum den bekannten Daten aus der PD-1-/PD-L1-gerichteten Immuntherapie höherer Tumorstadien.
Über mehr als ein Jahrzehnt konnten weder eine Modifikation der Lokaltherapie noch der systemischen Therapie die Behandlungsergebnisse im inoperablem Stadium III des NSCLC verbessern. Mit den Ergebnissen der PACIFIC-Studie gelingt es erstmals, den Nutzen der Immuntherapie aus der Behandlung metastasierter Stadien in eine potenziell kurative Behandlungssituation zu transferieren. Gleichzeitig unterstreichen die Daten den potenziell synergistischen Effekt einer kombinierten Radio- und Immuntherapie. Auch wenn die wichtigen Daten zum Gesamtüberleben noch ausstehen, haben die exzeptionellen Ergebnisse das Potenzial, schon jetzt eine Änderung der klinischen Praxis zu bewirken. Bei der gegebenen Dimension des PFS-Vorteils ist nur schwer vorstellbar, dass letztendlich keine klinisch signifikante Verbesserung auch im Gesamtüberleben resultieren wird.
Eine wichtige praktische Frage auf dem Gebiet der Immuntherapie wurde mit der Studie CheckMate-153 adressiert [3]: Muss die Therapie mit PD-1-Antikörpern dauerhaft durchgeführt werden oder ist eine zeitlich limitierte Therapie möglich? In früheren Studien wurde deutlich, dass einige Patienten, bei denen die Immuntherapie vorzeitig aufgrund von Nebenwirkungen oder nach einer vorgegebenen Therapiedauer beendet wurde, auch Jahre später keinen Progress aufwiesen. Eine theoretische Erklärung für diese Beobachtung könnte sein, dass mit der Therapie ein immunologisches Gedächtnis aufgebaut wird und die tumorgerichtete Immunantwort auch ohne fortgesetzte Behandlung bestehen bleibt.
In der von David Spigel präsentierten Studie wurden Patienten mit fortgeschrittenem NSCLC, die zuvor mit einer Chemotherapie behandelt worden waren und nach einer einjährigen Immuntherapie mit Nivolumab mindestens eine stabile Erkrankung aufwiesen, zwischen einer alleinigen Nachbeobachtung und einer fortgesetzten Therapie randomisiert. Bei der Würdigung der Daten muss berücksichtigt werden, dass die Studie eigentlich zur Erfassung höhergradiger immunvermittelter Nebenwirkungen konzipiert wurde und die Frage der Therapiedauer nur Gegenstand eines explorativen Endpunktes war. Von den ursprünglich 1245 eingeschlossenen Patienten waren 163 Patienten für die Wirksamkeitsanalyse auswertbar. Die Kurven für das progressionsfreie Überleben separieren früh und signifikant zugunsten der Patienten, die fortgesetzt mit Nivolumab behandelt wurden (Abb. 2).
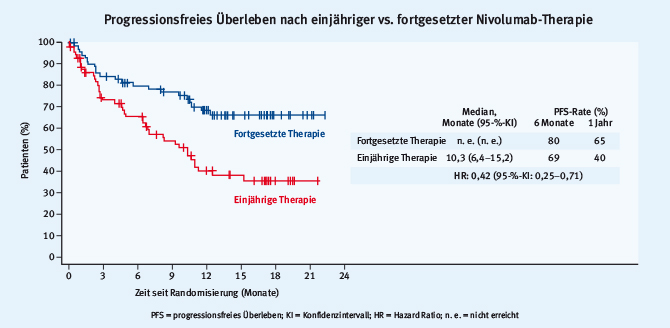 Abb. 2: Ergebnisse der CheckMate-153-Studie, progressionsfreies Überleben von Patienten mit fortgeschrittenem NSCLC und nicht progredienter Erkrankung unter einjähriger versus fortgesetzter Nivolumabtherapie (modifiziert nach [3])
Abb. 2: Ergebnisse der CheckMate-153-Studie, progressionsfreies Überleben von Patienten mit fortgeschrittenem NSCLC und nicht progredienter Erkrankung unter einjähriger versus fortgesetzter Nivolumabtherapie (modifiziert nach [3])Der signifikante Vorteil einer kontinuierlichen Immuntherapie wurde unabhängig vom Remissionsstatus zum Zeitpunkt der Randomisierung (stabile Erkrankung vs. partielle/komplette Remission) und in allen klinisch definierten Untergruppen beobachtet. Darüber hinaus war auch in der noch unreifen Analyse des Gesamtüberlebens ein Trend zum verlängerten OS für die kontinuierlich behandelten Patienten erkennbar (Hazard Ratio [HR] 0,63).
Patienten im Beobachtungsarm durften die Behandlung mit Nivolumab nach Progression der Erkrankung wiederaufnehmen. In der präsentierten Analyse der Patienten mit einer Progression alleine in einer Zielläsion (N = 11) bewirkte die Reexposition mit Nivolumab in keinem Fall eine Remission der Erkrankung.
Aufgrund der genannten Limitationen der CheckMate-153-Studie kann das Ergebnis allenfalls als Signal für eine kontinuierliche Immuntherapie wahrgenommen werden. Die Frage nach der optimalen Dauer der Immuntherapie muss – idealerweise unter Einbeziehung geeigneter Biomarker – in weiteren Studien mit adäquatem statistischen Design adressiert werden.
Fazit
- Die Konsolidierungstherapie mit Durvalumab führt zu einer signifikanten und klinisch relevanten Verlängerung des progressionsfreien Überlebens und stellt eine vielversprechende neue Behandlungsoption dar.
- Die CheckMate-153-Studie liefert ein deutliches Signal gegen eine Beendigung der Immuntherapie nach einem Jahr. Weitere Studien müssen die Frage nach der optimalen Therapiedauer beantworten.
“Mit der PACIFIC-Studie gelang es, den Nutzen der Immuntherapie erstmals auch in das lokal fortgeschrittene, inoperable Stadium III zu transferieren.” Dr. med. Jürgen Alt
Kombinationstherapie
Bekanntermaßen profitieren nur wenige Patienten in der zweiten Therapielinie längerfristig von einer alleinigen Immuntherapie mit einem PD-1- oder PD-L1-Antikörper. Auch eine Monochemotherapie hat nach einer platinbasierten Vortherapie eine nur begrenzte Wirksamkeit. Kombinationstherapien stellen einen interessanten Ansatzpunkt dar, um dem hohen Bedarf an effektiveren Therapien nachzukommen. Vor diesem Hintergrund untersuchte die ABOUND.2L+-Studie die Wirksamkeit einer kombinierten Therapie aus nab-Paclitaxel und CC-486 – einer oralen Applikationsform von Azacitidin – gegenüber einer alleinigen Behandlung mit nab-Paclitaxel bei Patienten mit Nicht-Plattenepithel-NSCLC nach einer platinbasierten Vorbehandlung [4]. Diese randomisierte Kohorte wurde im späteren Studienverlauf durch einen nicht randomisierten Behandlungsarm ergänzt, der die kombinierte Therapie aus nab-Paclitaxel und dem PD-L1 Antikörper Durvalumab untersuchte. In diese Kohorte konnten auch Patienten mit einem Plattenepithelkarzinom eingeschlossen werden. Auch eine Vorbehandlung mit einem Checkpointinhibitor war erlaubt. Die Ergebnisse wurden von Daniel Morgensztern als Late Breaking Abstract präsentiert. Die Kombination aus Chemotherapie und epigenetischer Therapie war der alleinigen Chemotherapie nicht überlegen (medianes PFS: 3,2 Monate versus 4,2 Monate; medianes OS: 8,4 versus 12,7 Monate). Die Kombination aus nab-Paclitaxel und Durvalumab zeigte zumindest keine unerwarteten oder kritischen Toxizitätssignale. Die präsentierten vorläufigen Effektivitätsdaten (PFS) lassen allerdings noch keine Rückschlüsse auf einen zukünftigen Stellenwert dieser Kombination aus Chemo- und Immuntherapie in der Zweit- oder Drittlinientherapie zu.
Fazit
- Die Kombination einer epigenetischen Therapie (orales Azacitidin) mit einer Chemotherapie (nab-Paclitaxel) ist der alleinigen Chemotherapie nicht überlegen.
Zielgerichtete Therapie
Das mit Spannung erwartete Highlight auf dem Gebiet der zielgerichteten Therapie wurde von Suresh Ramalingam im Presidential Symposium präsentiert [5]. Die Ergebnisse der FLAURA-Studie haben ebenfalls das Potenzial, die klinische Praxis zu verändern. In der globalen Phase-III-Studie wurden 556 Patienten mit einer aktivierenden Mutation des epithelialen Wachstumsfaktorrezeptors (EGFR) zwischen einer Erstlinienbehandlung mit einem der Erstgenerations-EGFR-Tyrosinkinaseinhibitoren (TKI) Erlotinib oder Gefitinib oder dem EGFR-TKI der dritten Generation Osimertinib randomisiert. Letzterer ist derzeit nur zur Behandlung von Patienten mit einer T790M-Mutation im EGFR-Gen zugelassen. Diese Mutation ist in ca. 50 Prozent der Fälle für eine sekundäre Resistenz gegenüber den Erst- oder Zweitgenerations-EGFR-TKI verantwortlich. Fast zwei Drittel der Patienten waren asiatischer Herkunft und etwa 20 Prozent wiesen zum Zeitpunkt des Einschlusses stabile Hirnmetastasen auf. Der primäre Endpunkt war das progressionsfreie Überleben.
Das mediane PFS unter Osimertinib betrug 18,9 Monate und lag deutlich über dem medianen PFS von 10,2 Monaten unter der Standardtherapie (HR = 0,46; p < 0,0001; Abb. 3).
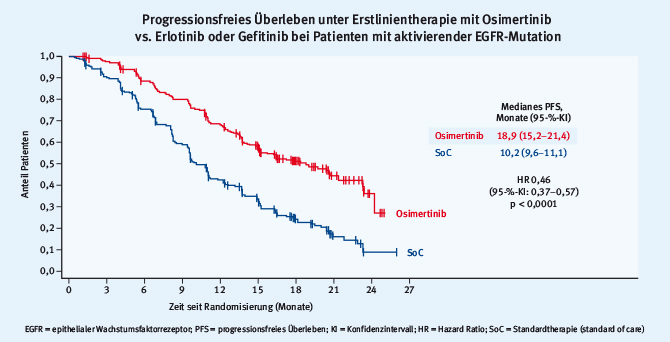 Abb. 3: Ergebnisse der FLAURA-Studie, progressionsfreies Überleben unter Therapie mit Osimertinib gegenüber Therapie mit Erlotinib oder Gefitinib (modifiziert nach [5])
Abb. 3: Ergebnisse der FLAURA-Studie, progressionsfreies Überleben unter Therapie mit Osimertinib gegenüber Therapie mit Erlotinib oder Gefitinib (modifiziert nach [5])Der Vorteil für Osimertinib war in allen definierten Subgruppen vorhanden. Patienten unter Osimertinib oder Standardbehandlung entwickelten in 6% bzw. 15% der Fälle Hirnmetastasen, was die aus früheren Studien bekannte gute Wirksamkeit der Substanz im zentralen Nervensystem untermauert. Auch in der noch unreifen Analyse des Gesamtüberlebens zeigte sich ein Trend zum längeren Überleben zugunsten der mit Osimertinib behandelten Patienten. Die (noch) nicht statistisch signifikante HR von 0,63 unterstreicht die beeindruckende Differenz im PFS. Auch das Toxizitätsprofil von Osimertinib war günstiger, insbesondere im Hinblick auf die klinisch relevante kutane Toxizität.
Aufgrund der noch unreifen Daten für das Gesamtüberleben ist zum jetzigen Zeitpunkt unklar, ob ein Erstlinieneinsatz von Osimertinib einer Therapiesequenz Zweitgenerations-EGFR-TKI gefolgt von Osimertinib überlegen sein wird. Gegen einen Einsatz von Osimertinib in der Erstlinie sprechen auch die noch unvollständig verstandenen Resistenzmechanismen und ihr Management. Eine entsprechende Zulassung vorausgesetzt, rechtfertigen die präsentierten Daten aber schon jetzt den Erstlinien-Einsatz bei Patienten mit bekannten Hirnmetastasen.
Bezüglich der Therapie von NSCLC mit Translokation der anaplastischen Lymphomkinase (ALK) wurde von Shirish Gadgeel ein Update der ALEX-Studie präsentiert [6]. Diese Studie verglich den Erstgenerations-ALK-TKI Crizotinib mit dem Zweitgenerations-ALK-TKI Alectinib in der Erstlinienbehandlung von Patienten mit ALK+ NSCLC. Die Studie wurde bereits auf dem diesjährigen ASCO-Kongress präsentiert und zeigte eine beeindruckende Verlängerung des medianen PFS (> 2 Jahre vs. 11,1 Monate) zugunsten der Alectinib-Therapie [7, 8]. In Madrid wurden die Effektivitätsdaten bezogen auf das zentrale Nervensystem aktualisiert beziehungsweise ergänzt.
Wir wissen um die gute intrakranielle Aktivität von ALK-Inhibitoren der zweiten Generation. Insofern war es nicht überraschend zu sehen, dass die ZNS-Kontrolle unter Alectinib über verschiedene Endpunkte hinweg und unabhängig von einer vorangegangenen Radiotherapie bedeutend besser war. Beispielhaft entwickelten innerhalb des ersten Jahres 31,5% der Patienten unter Crizotinib gegenüber nur 4,6% der Patienten unter Alectinib ZNS-Metastasen als Ort der ersten Progression.
Diese Ergebnisse zementieren Alectinib als neuen Standard in der Erstlinientherapie ALK+ NSCLC. Auch kann aufgrund der guten intrakraniellen Wirksamkeit sicher auf eine primäre Radiotherapie asymptomatischer Hirnmetastasen verzichtet werden. Insbesondere vor dem Hintergrund der mittlerweile langen Überlebenszeit von Patienten mit ALK+ NSCLC können damit späte Nebenwirkungen der Radiotherapie vermieden werden.
David Planchard präsentierte die abschließenden Ergebnisse der Phase-II-Studie BRF113928, die eine Therapie mit dem BRAF-Inhibitor Dabrafenib mit oder ohne dem MEK-Inhibitor Trametinib bei Patienten mit BRAF V600E-mutiertem NSCLC prüfte [9]. Die Präsentation wurde von einer Publikation in Lancet Oncology begleitet [10]. In der in Madrid gezeigten dritten Kohorte der Studie wurde die Kombination beider Inhibitoren bei bislang unbehandelten Patienten geprüft. Die Ergebnisse der ersten Kohorte (Monotherapie mit Dabrafenib) und zweiten Kohorte (Kombinationstherapie bei vorbehandelten Patienten) wurden bereits im vergangenen Jahr veröffentlicht [11] und zeigten im indirekten Vergleich eine bessere Wirksamkeit der Kombinationstherapie (Ansprechrate 67% vs. 33% und medianes PFS 10,2 Monate vs. 5,5 Monate). Basierend auf diesen Ergebnissen wurde die Kombinationstherapie im April dieses Jahres unabhängig von der Therapielinie in Europa zugelassen. Die in Madrid präsentierten Ergebnisse waren konsistent zu der zweiten Kohorte. Die Ansprechrate betrug 64% und das mediane PFS 10,9 Monate. Das noch präliminäre mediane Gesamtüberleben betrug 24,6 Monate und liegt damit im Bereich des OS von Patienten mit aktivierender EGFR-Mutation.
Fazit
- Osimertinib hat das Potenzial, neuer Standard in der Erstlinienbehandlung von NSCLC mit aktivierender EGFR-Mutation zu werden.
- Alectinib ist der neue Standard in der Erstlinientherapie ALK+ NSCLC und beweist seine Überlegenheit insbesondere in der Kontrolle von ZNS-Metastasen.
- Die Kombinationstherapie mit Dabrafenib und Trametinib sollte die Erstlinientherapie der ersten Wahl bei Patienten mit BRAF V600E-mutiertem NSCLC sein.
“Die Wirksamkeitsdaten und der bestehende Zulassungsstatus unterstreichen die Notwendigkeit, alle Patienten mit Adenokarzinomen auf das Vorhandensein einer BRAF V600E-Mutation zu überprüfen.” Dr. med. Jürgen Alt
Nachsorge früher NSCLC-Stadien
Die Ergebnisse einer weiteren für den klinischen Alltag relevanten Phase-III-Studie wurden von Virginie Westeel im Presidential Symposium präsentiert [12]. Die IFCT-0302-Studie verglich die Intensität der Nachsorge im Kontext früher NSCLC-Stadien. Auch die Leitlinie der DGHO [13] empfiehlt in dieser Situation eine intensivierte, strukturierte Nachsorge alle drei bis sechs Monate in den ersten zwei Jahren und nachfolgend jährlich. Inhalt dieser Untersuchungen sollte neben Anamnese und körperlicher Untersuchung auch eine Computertomografie des Thorax sein. Die Überlegenheit der Computertomografie gegenüber einer konventionellen Röntgenuntersuchung in Bezug auf eine Verlängerung der Überlebenszeit ist jedoch durch Studien nicht belegt. Die IFCT-0302-Studie ist die erste randomisierte Studie, die genau dieser Frage nachging. Insgesamt 1775 Patienten wurden nach kompletter operativer Resektion eines NSCLC entweder einer minimalen oder maximalen Nachsorge zugewiesen. Die minimale Nachsorge bestand aus Anamnese, körperlicher Untersuchung und Röntgenthorax. Bei Symptomen oder auffälligem Röntgenthorax war zusätzlich ein CT-Thorax erlaubt. Die maximale Nachsorge bestand zusätzlich aus einem CT-Thorax mit Kontrastmittel für alle Patienten sowie einer fiberoptischen Bronchoskopie für Plattenepithel- und großzellige Karzinome. Nach einer medianen Nachbeobachtungszeit von 8,7 Jahren zeigte sich kein signifikanter Unterschied im Gesamtüberleben zwischen den beiden Nachsorgeprogrammen (HR = 0,92). Lediglich im späten Kurvenverlauf wurde ein Trend zum längeren Überleben für die mittels CT untersuchten Patienten deutlich (medianes OS 123,6 Monate vs. 99,7 Monate; HR 0,37). Dieser Trend scheint darauf zurückzuführen zu sein, dass die CT-Untersuchung früher in der Lage ist, Zweitkarzinome zu erkennen.
Fazit
- Routinemäßige CT-Untersuchungen alle 6 Monate innerhalb der ersten zwei Nachsorgejahre sind nicht erforderlich. Jährliche CT-Untersuchungen sollten beibehalten werden.
Quellen
- Paz-Ares L et al. PACIFIC: A double-blind, placebo-controlled phase III study of durvalumab after chemoradiation therapy (CRT) in patients with stage III, locally advanced, unresectable NSCLC. Presidential Symposium, ESMO 2017, Madrid, abstract LBA1_PR.
- Antonia SJ et al. Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med 2017.
- Spigel DR et al. Randomized results of fixed-duration (1-yr) vs continuous nivolumab in patients (pts) with advanced non-small cell lung cancer (NSCLC). Presented at Proffered Paper session, ESMO 2017, Madrid, abstract 1297O.
- Morgensztern D et al. ABOUND.2L+: nab-paclitaxel (nab-P) +/- CC-486 or durvalumab in previously treated patients with advanced non-small cell lung cancer (NSCLC). Proffered Paper session, ESMO 2017, Madrid, abstract LBA48.
- Ramalingam S et al. Osimertinib vs standard of care (SoC) EGFR-TKI as first-line therapy in patients (pts) with EGFRm advanced NSCLC: FLAURA. Presidential Symposium, ESMO 2017, Madrid, abstract LBA2_PR.
- Gadgeel S et al. Alectinib vs crizotinib in treatment-naïve ALK+ NSCLC: CNS efficacy results from the ALEX study. Presented at Proffered Paper session, ESMO 2017, Madrid, abstract 1298O.
- Shaw AT et al. Alectinib Versus Crizotinib in Treatment-Naive Advanced ALK Positive Non-Small Cell Lung Cancer (NSCLC): Primary Results of the Global Phase III ALEX Study. J Clin Oncol 35, 2017 (suppl; abstr LBA9008).
- Peters S et al. Alectinib versus Crizotinib in Untreated ALK-Positive Non–Small-Cell Lung Cancer. New England Journal of Medicine 2017; 377: 829-838.
- Planchard D et al. Phase 2 trial (BRF113928) of dabrafenib (D) plus trametinib (T) in patients (pts) with previously untreated BRAF V600E–mutant metastatic non-small cell lung cancer (NSCLC). Presented at Proffered Paper session, ESMO 2017, Madrid, abstract LBA51.
- Planchard D et al. Dabrafenib plus trametinib in patients with previously untreated BRAFV600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol 2017.
- Planchard D et al. Dabrafenib in patients with BRAF(V600E)-positive advanced non-small-cell lung cancer: a single-arm, multicentre, open-label, phase 2 trial. Lancet Oncol 2016; 17: 642-650.
- Westeel V et al. Results of the phase III IFCT-0302 trial assessing minimal versus CT-scan-based follow-up for completely resected non-small cell lung cancer (NSCLC). Presented at Presidential Symposium, ESMO 2017, Madrid, abstract 1273O.
- Griesinger F et al. DGHO-Onkopedia-Leitlinie Lungenkarzinom, nicht-kleinzellig (NSCLC), 2017, DGHO Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e. V.
- Bildnachweis: „crystal palece of El Retiro park, Madrid”: © MIGUEL GARCIA SAAVED/Fotolia