ASCO 2016
3. bis 7. Juni, Chicago
Mammakarzinom: Highlights zur Therapie vom ASCO 2016 (Priv.-Doz. Dr. Marc Thill, Frankfurt am Main)
Mammakarzinom: aktuelle Ergebnisse der ETNA-Studie (Priv.-Doz. Dr. Marc Thill, Frankfurt am Main)
 Vom 3. bis 7. Juni fand in Chicago die Jahrestagung 2016 der American Society of Clinical Oncology (ASCO) statt. Mehr als 37.000 Teilnehmer aus 80 Ländern trafen sich auf dem Kongress, um die neuesten Daten aus der Onkologie zu diskutieren. Lesen Sie hier das Aktuellste und Wichtigste vom ASCO 2016 zu den Themen Pankreaskarzinom, Mammakarzinom und nichtkleinzelliges Lungenkarzinom.
Vom 3. bis 7. Juni fand in Chicago die Jahrestagung 2016 der American Society of Clinical Oncology (ASCO) statt. Mehr als 37.000 Teilnehmer aus 80 Ländern trafen sich auf dem Kongress, um die neuesten Daten aus der Onkologie zu diskutieren. Lesen Sie hier das Aktuellste und Wichtigste vom ASCO 2016 zu den Themen Pankreaskarzinom, Mammakarzinom und nichtkleinzelliges Lungenkarzinom.
Liebe Kolleginnen und Kollegen,
einmal im Jahr findet in Chicago die Tagung der American Society of Clinical Oncology (ASCO) statt. So pilgerten auch in diesem Jahr mehr als 37.000 Teilnehmer aus 80 Ländern nach Chicago, um die neuesten Daten aus der Onkologie zu erleben und kritisch zu diskutieren.
Für diesen Artikel haben wir die aus unserer Sicht wichtigsten Daten zu den Themen Pankreaskarzinom, Mammakarzinom und nichtkleinzelliges Lungenkarzinom zusammengefasst und den Schwerpunkt auf die Daten gelegt, die in Ihrer täglichen Praxis für Sie die größte Bedeutung haben dürften.
Wir wünschen Ihnen eine spannende Lektüre und freuen uns, wenn Sie über die Funktion „Ihre Meinung ist wichtig“ eine kurze Bewertung zu den Beiträgen abgeben.
Mit kollegialen Grüßen
 Dr. med. Akin Atmaca, Krankenhaus Nordwest, Frankfurt am Main
Dr. med. Akin Atmaca, Krankenhaus Nordwest, Frankfurt am Main Dr. med. Alexander König, Universitätsmedizin Göttingen
Dr. med. Alexander König, Universitätsmedizin Göttingen Priv.-Doz. Dr. med. Marc Thill, AGAPLESION Markus Krankenhaus, Frankfurt am Main
Priv.-Doz. Dr. med. Marc Thill, AGAPLESION Markus Krankenhaus, Frankfurt am MainPankreaskarzinom: Eröffnung neuer Behandlungsmöglichkeiten, Optimierung bestehender Optionen
Dr. med. Alexander König, Universitätsmedizin Göttingen
 Bei der Therapie des Pankreaskarzinoms (PACA) führten in den letzten Jahren verschiedene Neuentwicklungen wie die Einführung des FOLFIRINOX-Protokolls oder die Entwicklung von nab-Paclitaxel zu einer signifikanten Verbesserung des Überlebens. Auf dem diesjährigen ASCO-Kongress wurden jetzt grundlegende Daten zur Verbesserung der adjuvanten Therapie, potentielle Behandlungssequenzen und Kombinationen der wirksamen Therapieprotokolle mit neuen Substanzen sowie mögliche Biomarker und neue Ansatzpunkte für zielgerichtete Therapien vorgestellt.
Bei der Therapie des Pankreaskarzinoms (PACA) führten in den letzten Jahren verschiedene Neuentwicklungen wie die Einführung des FOLFIRINOX-Protokolls oder die Entwicklung von nab-Paclitaxel zu einer signifikanten Verbesserung des Überlebens. Auf dem diesjährigen ASCO-Kongress wurden jetzt grundlegende Daten zur Verbesserung der adjuvanten Therapie, potentielle Behandlungssequenzen und Kombinationen der wirksamen Therapieprotokolle mit neuen Substanzen sowie mögliche Biomarker und neue Ansatzpunkte für zielgerichtete Therapien vorgestellt.
Adjuvante Therapie
Einen der wichtigsten Erkenntnisgewinne des diesjährigen ASCO-Kongresses lieferte die Vorstellung der Ergebnisse der ESPAC-4-Studie. Über viele Jahre war es Therapiestandard, Patienten mit resektablem PACA in der adjuvanten Situation mit einer Gemcitabin(Gem)-Monotherapie zu behandeln. Nun zeigt die Auswertung der randomisiert prospektiven, internationalen, multizentrischen Phase-III-Studie mit 730 Patienten, dass eine Intensivierung der adjuvanten Therapie durch Kombination von Gemcitabin mit Capecitabin (Gem+Cap) zu einer Verlängerung des Gesamtüberlebens (OS) führt [1]. So kann ein mittlerer Überlebensvorteil von 2,5 Monaten (25,5 Monate vs. 28 Monate; p = 0,03) für Gem+Cap gegenüber der Monotherapie mit Gem nachgewiesen werden (Abb. 1).
Mehr noch suggeriert die annähernde Verdopplung des 5-Jahresüberlebens von 16% auf 29%, dass eine Subpopulation von Patienten ganz besonders von der Kombination in der adjuvanten Situation profitiert.
 Abb. 1: Gesamtüberleben der Patienten in der ESPC-4-Studie (modifiziert nach [1]).
Abb. 1: Gesamtüberleben der Patienten in der ESPC-4-Studie (modifiziert nach [1]).Nicht unerwartet geht dieser Überlebensvorteil mit einer gesteigerten Toxizität einher, die jedoch moderat ausfällt. So zeigt sich eine Zunahme der Grad-3/4-Toxizität für Diarrhoe (2% vs. 5%) und das Hand-Fuß-Syndrom (0% vs. 7%) im Kombinationsarm.
Ob eine weitere Intensivierung der adjuvanten Therapie auch zu einer Verbesserung des OS führen kann, wird die Auswertung der APACT(Gem vs. Gem+nab-Paclitaxel)- und der PRODIGE/UNICANCER(Gem vs. mFOLFIRINOX)-Studie zeigen müssen.
„Die Kombination von Gemcitabin und Capecitabin wird mit hoher Wahrscheinlichkeit der neue Standard in der adjuvanten Therapie des PACA werden.“ Dr. Alexander König
Neoadjuvante Therapie
Eine der wichtigsten Prädiktoren für das Gesamtüberleben bei Patienten mit resektablem PACA stellt die Rate an R0-, R1- oder R2-Resektionen dar, wobei eine R0-Resektion mit dem längsten OS assoziiert ist. Deshalb versuchen neue Therapieansätze mit neoadjuvanter beziehungsweise perioperativer Therapie die Rate an R0-Resektionen zu erhöhen. Ergebnisse der jetzt vorgestellten, einarmigen Pilotstudien legen nahe, dass eine perioperative Therapie mit einer Kombination von Gem+nab-Paclitaxel (2 Zyklen präoperativ und 4 Zyklen postoperativ) die Anzahl an R0-Resektionen erhöhen und das OS für die meisten Patienten positiv beeinflussen kann. Dabei hatten Patienten, die auf die neoadjuvante Therapie im Rahmen der AGITG- GAP-Studie bildgebend ein Ansprechen zeigten, eine deutlich erhöhte Wahrscheinlichkeit für eine R0-Resektion (2,45-fach erhöht, p = 0,01) [2]. Folgerichtig korreliert bei einer neoadjuvanten Vorbehandlung ein hoher pathologischer Regressionsgrad (GRT 0 oder 1) signifikant mit einem langen medianen OS von 30,6 Monaten während für einen niedrigen GRT (2 oder 3) ein medianes Überleben von nur 16,5 Monaten angegeben wurde (p = 0,008) [3].
Interessant sind neoadjuvante Therapiekonzepte auch deshalb, weil intensivierte Therapien von vielen Patienten postoperativ nicht toleriert werden. Konnten in der AGITG-GAP-Studie noch 93% der Patienten eine intensive Vorbehandlung mit Gem+nab-Paclitaxel präoperativ erhalten, so sank dieser Wert postoperativ auf nur noch 60% [2]. Ähnliche Ergebnisse zeigten sich auch für die perioperative Behandlung mit FOLFIRINOX, womit präoperativ 95% der Patienten und postoperativ nur noch 67% therapiert werden konnten [4]. In dieser kleinen Studie konnten von 21 eingeschlossenen Patienten 17 Patienten reseziert werden (16 Patienten R0 und 1 Patient R1), wobei für 59% ein histologisches Therapieansprechen gezeigt werden konnte. Das mediane OS der so behandelten Patienten wurde mit erstaunlichen 33,4 Monaten angegeben, wobei Grad-3/4-Toxizitätsraten von circa 25% auftraten. Definitive Aussagen, ob eine und welche perioperative Therapiestrategie bei resektablem PACA sinnvoll erscheint, müssen die derzeit laufenden oder vorgestellten Studien NEONAX [5] und SWOG S1505 [6] zeigen.
„Perioperative Therapiestrategien mit dem Ziel einer Erhöhung der R0-Resektionsrate stellen vielversprechende und sichere Optionen für die Zukunft dar. Zum jetzigen Zeitpunkt jedoch bleibt eine neoadjuvante Behandlung von potentiell resektablen PACA klinischen Studien vorbehalten.“ Dr. Alexander König
Palliative Therapie
Seit in der Therapie des fortgeschrittenen PACA mit FOLFIRINOX und Gem+nab-Paclitaxel mehrere wirksame Therapieoptionen mit akzeptabler Toxizität zur Verfügung stehen, stellt sich im klinischen Alltag die Frage nach den richtigen Patienten für das jeweilige Therapieregime sowie einer potentiellen Therapiesequenz.
Eine retrospektive Analyse der Verwendungsrealität von FOLFIRINOX, Gem+nab-Paclitaxel und Gem in der Erstlinienbehandlung des fortgeschrittenen PACA in British Columbia (Canada) zeigte bei 150 Patienten die Verwendung von FOLFIRINOX in 39%, von Gem+nab-Paclitaxel in 39% und von Gem in 22% der Fälle [7]. In Bestätigung der Zulassungsstudien konnte bei ungleichen Patientenkollektiven (jüngere Patienten und besserer ECOG in der FOLFIRINOX-Studie) ein Überlebensvorteil von FOLFIRINOX und Gem+nab-Paclitaxel gegenüber einer Gem-Monotherapie (7,8 Monate bzw. 8,5 Monate vs. 3,1 Monate) auch im klinischen Alltag nachgewiesen werden. Toxizitätsanalysen sehen dabei einen Vorteil für Gem+nab-Paclitaxel (17% Therapieunterbrechungen, TU) gegenüber Gem (23% TU) und FOLFIRINOX (36% TU), während andere Analysen einen Kosten-Nutzen-Vorteil für FOLFIRINOX gegenüber Gem+nab-Paclitaxel und Gem in den USA errechneten [8].
Für den klinischen Alltag ist ähnlich bedeutsam, dass nab-Paclitaxel in der Erstlinientherapie nicht auf die Kombination mit Gem festgelegt zu sein scheint. So konnte durch eine Phase-II-Studie (AFUGEM) mit 114 Patienten gezeigt werden, dass sich weder ORR (39,5% vs. 35,1%) noch PFS (4,9 Monate vs. 6,0 Monate) signifikant ändern, wenn nab-Paclitaxel mit Gem oder mit 5-FU/LV kombiniert wird [9]. Bezüglich des OS ergibt sich sogar ein vorteilhafter Trend für die Kombination nab-Paclitaxel mit 5-FU/LV (9,2 Monate vs. 11,4 Monate) bei mäßig erhöhtem Toxizitätsprofil.
Auch eine sequenzielle Kombination von Gem+nab-Paclitaxel mit einer 5-FU-haltigen Zweitlinientherapie erscheint anhand einer retrospektiven Auswertung von 240 Patienten bei 55% der Patienten dieser Kohorte möglich zu sein [10]. Patienten, für die eine Zweitlinientherapie möglich war, hatten dabei ein signifikant besseres OS (13,5 Monate vs. 6,8 Monate; p < 0,0001). Interessanterweise ergibt sich in dieser Analyse kein signifikanter Vorteil bezüglich OS für eine spezifische Zweitlinientherapie (FOLFOX/XELOX: 12,9 Monate; FOLFIRI: 13,2 Monate; FOLFIRINOX: 13,8 Monate; andere: 12,3 Monate).
Häufige Toxizitäten, die durch das FOLFIRINOX-Regime ausgelöst werden, können durch eine Modifikation des Protokolls mit dem Weglassen des 5-FU-Bolus deutlich reduziert werden, wobei kein größerer Wirkverlust beobachtet wurde [11].
„Solange keine randomisierten Head-to-Head-Vergleiche von FOLFIRINOX und nab-Paclitaxel existieren, kann keine Überlegenheit für eine der beiden Therapieregimes gesehen werden. Sequentielle Behandlungen mit beiden Protokollen sowie Dosismodifikationen erscheinen in Abhängigkeit des Patienten möglich.“ Dr. Alexander König
Neue Therapieansätze – was wird funktionieren, was könnte funktionieren, was ist experimentell interessant?
Was wird funktionieren?
Aufgrund der sich weiter verbessernden Prognose auch für Patienten mit fortgeschrittenem PACA besteht für eine immer größere Anzahl von Patienten die Notwendigkeit zu nachrangigen Therapielinien und neuen Behandlungskonzepten. In diesem Kontext konnte bereits eine Überlegenheit für die Kombination von nanoliposomalem Irinotecan (nal-IRI) mit 5-FU/LV gegenüber 5-FU/LV in der Zweitlinientherapie nach Progress unter Gem im Rahmen der NAPOLI-1-Studie nachgewiesen werden. Langzeitdaten bestätigen jetzt die Überlegenheit dieser Kombination für das OS (6,2 Monate vs. 4,2 Monate; p = 0,04) bei unverändertem Toxizitätsprofil [12]. Die Zulassung von nal-IRI durch die FDA erfolgte bereits Ende letzten Jahres, eine Zulassung für das fortgeschrittene PACA im europäischen Raum wird in Kürze erwartet.
„Durch die Kombination von nal-IRI mit 5-FU/LV steht in Kürze eine wirksame Zweitlinientherapie nach Progress unter Gemcitabin zur Verfügung.“ Dr. Alexander König
Ein weiterer vielversprechender Therapieansatz besteht in der Modifikation des für das PACA charakteristischen Tumorstromas. Eine jetzt vorgestellte Arbeit konnte bei 135 Patienten zeigen, dass es bei Patienten mit hoher Hyaluronsäurekonzentration im Tumorstroma durch die Kombination von PEGylierter rekombinanter humaner Hyaluronidase (PEGPH20) mit Gem+nab-Paclitaxel zu einer klinisch bedeutsamen Verbesserung des Ansprechens (ORR 55% vs. 33%) und des progressionsfreien Überlebens (6,0 vs. 9,2 Monate) im Vergleich zur Therapie mit Gem+nab-Paclitaxel kommt (Abb. 2) [13].
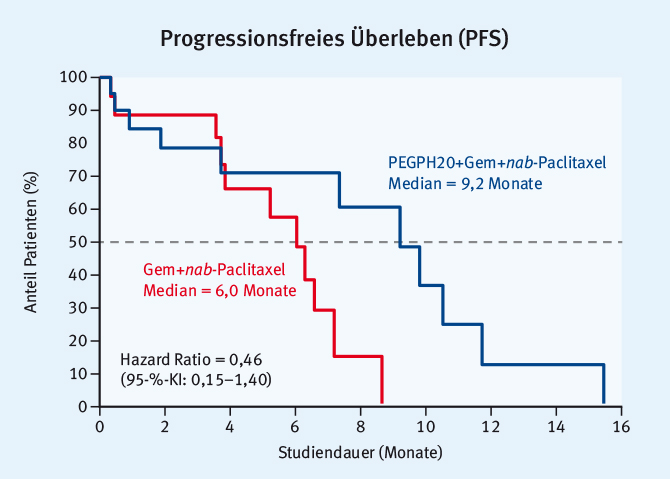 Abb. 2: Progressionsfreies Überleben von Patienten mit hohen Konzentrationen von Hyaluronsäure im Tumorstroma und Behandlung mit PEGPH20+Gem+nab-Paclitaxel oder Gem+nab-Paclitaxel (modifiziert nach [13]).
Abb. 2: Progressionsfreies Überleben von Patienten mit hohen Konzentrationen von Hyaluronsäure im Tumorstroma und Behandlung mit PEGPH20+Gem+nab-Paclitaxel oder Gem+nab-Paclitaxel (modifiziert nach [13]).Was könnte funktionieren?
Eine vielversprechende Therapieoption beim fortgeschrittenen PACA stellt die Behandlung mit Hypoxie-induzierbarem Ifosfamid (Evofosfamid, Evo) dar. In der jetzt vorgestellten Phase-III-Studie (MAESTRO) konnte jedoch keine Verbesserung des medianen OS von Evo gegenüber Gem mit 8,7 Monaten vs. 7,6 Monate gezeigt werden, auch wenn das PFS mit 5,5 Monaten vs. 3,1 Monate signifikant besser war [14]. Mit einer HR von 0,84 (95-%-KI: 0,71–1,01; p = 0,059) wurde das Signifikanzniveau für das OS knapp verfehlt, auch wenn die Kurven für die beiden Behandlungsarme mit zunehmender Behandlungsdauer separieren und diese Separation aufrechterhalten bleibt (Abb. 3). Diese Ergebnisse legen nahe, dass eine Subpopulation von Patienten von dieser Therapie profitieren könnte, wobei ein Biomarker für die Wirksamkeit von Evo nicht bekannt ist. Auf eine Stratifizierung der Patienten – zum Beispiel nach dem Ausmaß hypoxischer Tumorareale – wurde leider verzichtet.
 Abb. 3: Evofosfamid+Gem vs. Placebo+Gem bei Patienten mit lokal fortgeschrittenem nicht resezierbarem oder metastasiertem PACA: Gesamtüberleben in der MAESTRO-Studie (modifiziert nach [14]).
Abb. 3: Evofosfamid+Gem vs. Placebo+Gem bei Patienten mit lokal fortgeschrittenem nicht resezierbarem oder metastasiertem PACA: Gesamtüberleben in der MAESTRO-Studie (modifiziert nach [14]).Ob die an der Entwicklung beteiligten Unternehmen angesichts dieser Ergebnisse an einer Weiterentwicklung von Evo beim PACA interessiert sind, ist nicht gesichert. In diesem Zusammenhang erscheint auch fraglich, ob potentiell vielversprechende Kombinationen von Evo mit anderen Substanzen wie nab-Paclitaxel weiterverfolgt werden [15].
„Die MAESTRO-Studie konnte leider keine Überlegenheit von Evo+Gem gegenüber Gem zeigen, wobei eine Subpopulation von Evo zu profitieren scheint. Leider wurde auf eine Stratifizierung der Patienten verzichtet.“ Dr. Alexander König
Was ist experimentell interessant?
Einen wichtigen Teil des diesjährigen ASCO-Kongresses nahm die Detektion von Mutationen im Tumor und die daraus resultierende Identifikation prognostisch relevanter Biomarker oder therapeutisch nutzbarer Targets für potentielle Zweit- oder Drittlinientherapien ein. Hierbei konnten im Wesentlichen kürzlich veröffentlichte Arbeiten bestätigt werden [16], die nahelegen, dass mit Ausnahme der onkogenen Mutationen im Kras- und TP53-Gen sowie dem Verlust von DPC4 keine weiteren Mutationen mit größerer Häufigkeit beim PACA vorkommen [17]. In diesem Kontext konnten Mutationen in den DNA-Reparaturgenen BRCA1/2 als relevant für die Karzinogenese und die Therapie des PACA beschrieben werden. Hierbei scheint neben der Verwendung Platin-basierter Therapien auch die Verwendung des PARP-Inhibitors Rucaparib für einen signifikanten Patientenanteil von Vorteil zu sein [18, 19].
Fazit
Zusammenfassend lässt sich sagen, dass im Rahmen des diesjährigen ASCO-Kongresses standardsetzende Innovationen zur adjuvanten Therapie, Neuerungen in der Zweitlinientherapie und potentielle Therapiesequenzen in der Palliation vorgestellt worden sind, die zeitnah Einzug in die klinische Behandlung des PACA halten werden. Es wurden Daten präsentiert, die eine perioperative Behandlung von resektablen Tumoren sinnvoll erscheinen lassen und die jetzt in größeren Studien überprüft werden. Darüber hinaus werden in Zukunft Tumorbiologie und molekulare Marker eine zunehmende Bedeutung bei der Auswahl potentieller Therapeutika und Therapiestrategien beim PACA im Sinne einer individualisierten Tumortherapie haben.
Essentielle Aspekte des diesjährigen ASCO-Kongresses
- Gem+Cap stellt die derzeit effektivste adjuvante Therapie des Pankreaskarzinoms dar.
- Neoadjuvante/perioperative Therapiekonzepte sind interessante Strategien für die Zukunft.
- Kombinationstherapien (FOLFIRINOX und Gem+nab-Paclitaxel) bestimmen den Standard in der Therapie des fortgeschrittenen Pankreaskarzinoms.
- Sequenzielle Kombinationen von Gem+nab-Paclitaxel mit einer 5-FU-haltigen Zweitlinientherapie können möglicherweise das Überleben der Patienten verbessern.
- Vielversprechende Ansätze zur Erweiterung des therapeutischen Spektrums beim fortgeschrittenen Pankreaskarzinom sind die Kombination von nanoliposomalem Irinotecan (nal-IRI) mit 5-FU/LV sowie die Modifikation des Tumorstromas mit PEGylierter rekombinanter humaner Hyaluronidase (PEGPH20).
- Molekulare Stratifizierungen gewinnen für die Therapie des Pankreaskarzinoms in Zukunft vermehrt an Bedeutung
Quellen
- Neoptolemos JP et al. ESPAC-4: A multicenter, international, open-label randomized controlled phase III trial of adjuvant combination chemotherapy of gemcitabine (GEM) and capecitabine (CAP) versus monotherapy gemcitabine in patients with resected pancreatic ductal adenocarcinoma. J Clin Oncol 34, 2016 (suppl; abstr LBA4006).
- Barbour A et al. Initial survival outcomes for the AGITG GAP study – a phase II study of perioperative nab-paclitaxel and gemcitabine for resectable pancreatic ductal adenocarcinoma (PDAC). J Clin Oncol 34, 2016 (suppl; abstr 4105).
- Alvarez-Gallego R et al. Pathological response to neoadjuvant gemcitabine plus nabpaclitaxel in pancreatic adenocarcinoma to improve survival. J Clin Oncol 34, 2016 (suppl; abstr 4109).
- de Wilton Marsh R et al. Peri-operative modified FOLFIRINOX in resectable pancreatic cancer: A pilot study. J Clin Oncol 34, 2016 (suppl; abstr 4103).
- Ettrich TJ et al. NEONAX: Neoadjuvant plus adjuvant or only adjuvant nab-paclitaxel plus gemcitabine for resectable pancreatic cancer—A phase II study of the AIO Pancreatic Cancer Group. J Clin Oncol 32:5s, 2014 (suppl; abstr TPS4158).
- Sohal D et al. SWOG S1505: A randomized phase II study of perioperative mFOLFIRINOX vs. gemcitabine/nab-paclitaxel as therapy for resectable pancreatic adenocarcinoma. J Clin Oncol 34, 2016 (suppl; abstr TPS4151).
- Wang Y et al. Comparative effectiveness of FOLFIRINOX or nab-paclitaxel plus gemcitabine in locally advanced or metastatic pancreatic cancer: A population-based analysis. J Clin Oncol 34, 2016 (suppl; abstr 6561).
- Gharaibeh M et al. Optimized economic evaluation for the United States (US) of nab-paclitaxel plus gemcitabine (NAB-P+GEM), FOLFIRINOX (FFX), and gemcitabine (GEM) as first-line treatment for metastatic pancreatic cancer (mPDA). J Clin Oncol 34, 2016 (suppl; abstr 4113).
- Hammel P et al. Nab-paclitaxel plus gemcitabine or plus simplified LV5FU2 as first-line therapy in patients with metastatic pancreatic adenocarcinoma: A GERCOR randomized phase II study (AFUGEM). J Clin Oncol 34, 2016 (suppl; abstr 4120).
- Giordano G et al. Impact of second-line treatment (2L T) in advanced pancreatic cancer (APDAC) patients (pts) receiving first line Nab-Paclitaxel (nab-P) + Gemcitabine (G): an Italian multicentre real life experience. J Clin Oncol 34, 2016 (suppl; abstr 4124).
- Ueno M et al. Phase II study of modified FOLFIRINOX for chemotherapy-naïve patients with metastatic pancreatic cancer. J Clin Oncol 34, 2016 (suppl; abstr 4111).
- Wang-Gillam A et al. Updated overall survival (OS) analysis of NAPOLI-1: Phase 3 study of nanoliposomal irinotecan (nal-IRI, MM-398), with or without 5-fluorouracil and leucovorin (5-FU/LV), vs 5-FU/LV in metastatic pancreatic cancer (mPAC) previously treated with gemcitabine (gem)-based therapy. J Clin Oncol 34, 2016 (suppl; abstr 4126).
- Bullock AJ et al. Final analysis of stage 1 data from a randomized phase II study of PEGPH20 plus nab-Paclitaxel/gemcitabine in stage IV previously untreated pancreatic cancer patients (pts), utilizing Ventana companion diagnostic assay. J Clin Oncol 34, 2016 (suppl; abstr 4104).
- Van Cutsem E et al. MAESTRO: A randomized, double-blind phase III study of evofosfamide (Evo) in combination with gemcitabine (Gem) in previously untreated patients (pts) with metastatic or locally advanced unresectable pancreatic ductal adenocarcinoma (PDAC). J Clin Oncol 34, 2016 (suppl; abstr 4007).
- Borad MJ et al. Evofosfamide combined with gemcitabine/nab-paclitaxel in patients with previously untreated locally advanced or metastatic pancreatic adenocarcinoma (PAC): Results of a phase I trial. J Clin Oncol 34, 2016 (suppl; abstr 4114).
- Waddell N et al. Whole genomes redefine the mutational landscape of pancreatic cancer. Nature 2015; 518: 495-501.
- Jordan E et al. Genomic profiling of pancreas ductal adenocarcinoma (PDA), actionability, and correlation with clinical phenotype. J Clin Oncol 34, 2016 (suppl; abstr 4127).
- Domchek SM et al. RUCAPANC: An open-label, phase 2 trial of the PARP inhibitor rucaparib in patients (pts) with pancreatic cancer (PC) and a known deleterious germline or somatic BRCA mutation. J Clin Oncol 34, 2016 (suppl; abstr 4110).
- Aung KL et al. Overall survival of patients with pancreatic adenocarcinoma and BRCA1 or BRCA2 germline mutation. J Clin Oncol 34, 2016 (suppl; abstr 4123).
- Bildnachweis: „Aerial view of Chicago downtown in Illinois, USA”: © filipefrazao/Fotolia; "Chicago Boat Tour": © sianamira/Fotolia
Mammakarzinom: Highlights zur Therapie vom ASCO 2016
Priv.-Doz. Dr. med. Marc Thill, AGAPLESION Markus Krankenhaus, Frankfurt am Main
 Auf der diesjährigen Jahrestagung der American Society of Clinical Oncology (ASCO) stachen für die Erstlinientherapie des fortgeschrittenen, HR-positiven, HER2-negativen Mammakarzinoms insbesondere die Daten der PALOMA-2-Studie mit beeindruckenden Vorteilen hinsichtlich des progressionsfreien Überlebens (PFS) für die Kombination aus Palbociclib und Letrozol hervor. Im Bereich der Immunchemotherapie wird deutlich, dass PD1- und PDL1-Inhibitoren als Monotherapie keine Zukunft haben, sondern einen Chemotherapie-Kombinationspartner benötigen, idealerweise nab-Paclitaxel. Darüber hinaus gab es eine Reihe hochinteressanter Diskussionen zur adjuvanten und neoadjuvanten Therapie, über die im Folgenden ebenfalls berichtet wird.
Auf der diesjährigen Jahrestagung der American Society of Clinical Oncology (ASCO) stachen für die Erstlinientherapie des fortgeschrittenen, HR-positiven, HER2-negativen Mammakarzinoms insbesondere die Daten der PALOMA-2-Studie mit beeindruckenden Vorteilen hinsichtlich des progressionsfreien Überlebens (PFS) für die Kombination aus Palbociclib und Letrozol hervor. Im Bereich der Immunchemotherapie wird deutlich, dass PD1- und PDL1-Inhibitoren als Monotherapie keine Zukunft haben, sondern einen Chemotherapie-Kombinationspartner benötigen, idealerweise nab-Paclitaxel. Darüber hinaus gab es eine Reihe hochinteressanter Diskussionen zur adjuvanten und neoadjuvanten Therapie, über die im Folgenden ebenfalls berichtet wird.
Neoadjuvante Chemotherapie
Die neoadjuvante Therapie des HER2-positiven Mammakarzinoms mit einer dualen Blockade aus den monoklonalen Antikörpern Trastuzumab und Pertuzumab konnte bereits in der NeoSphere- [1] und der TRYPHAENA-Studie [2] überzeugen. Eine weitere Substudie des WSG-ADAPT-Umbrella-Studien-Konzepts lieferte nun Daten für die Kombination aus Trastuzumab plus Pertuzumab q3w +/- Paclitaxel 80 mg/m² wöchentlich in einem zwölfwöchigen Regime [3]. In dieser zweiarmigen Phase-II-Studie mit 134 HER2-positiven, Hormonrezeptor(HR)-negativen Patientinnen konnte für die duale Blockade ohne Chemotherapie zwar eine respektable Rate an pathologisch kompletten Remissionen (pCR; ypT0/is, ypN0) von 34,4% erreicht werden, in der Kombination mit Paclitaxel wurde die pCR allerdings auf 90,5% und damit um mehr als das Doppelte gesteigert (p < 0,001). Hinsichtlich der Toxizität beider Arme kann konstatiert werden, dass keine neuen Nebenwirkungen detektiert wurden und sich die Nebenwirkungen in einem tolerablen Rahmen hielten.
Adjuvante Chemotherapie
Ob eine Anthrazyklin-freie Chemotherapie mit sechs Zyklen Docetaxel+Cyclophosphamid (TC) beim HER2-negativen, frühen, High-Risk-Mammakarzinom dem Vergleich mit einer Anthrazyklin-, Cyclophosphamid- und Taxan-haltigen (TaxAC) Chemotherapie standhalten würde, wurde von den ABC-Studien untersucht. In diesen Phase-III-Studien mit insgesamt 4.242 Patientinnen wurden sechs Zyklen TC q3w mit vier Optionen einer TaxAC-Chemotherapie (6xTAC q3w, 4xAC q3w oder 4xAC q2w gefolgt von jeweils 12xPaclitaxel q1w oder 4xAC q2w gefolgt von Paclitaxel q2w) verglichen [4]. Präsentiert wurden eine Interimsanalyse mit einem Follow-up von 3,2 Jahren, die eine signifikante Verbesserung des invasiven krankheitsfreien Überlebens (iDFS) von 2,5% für den TaxAC-Arm (88,2% vs. 90,7%, Hazard Ratio = 1,23; 95-%-KI: 1,01–1,50; p = 0,04) zeigte. In der explorativen Subgruppenanalyse war der Vorteil vor allem in der Gruppe der HR+/nodal-positiven (≥ 4 Lymphknoten) und der HR-/nodal-positiven Kohorte evident (5,8%–11,0%). Die Gruppe der HR+/1–3 LK und der HR-/nodal-negativen Kohorte konnten durch TaxAC nur einen Vorteil von 2,0%–2,5% erreichen. Die Studie zeigt einmal mehr, dass ein Deeskalieren der Chemotherapie in Hochrisikopopulationen nicht sinnvoll ist.
Die PANTHER-Studie, eine Phase-III-Studie mit 2.006 Patientinnen, bei der auch viele deutsche Zentren beteiligt waren, untersuchte in einem zweiarmigen Design vier Zyklen tdd (tailored dose-dense) Epirubicin+Cyclophosphamid (EC) q2w gefolgt von vier Zyklen tdd Docetaxel (D) q2w (tdd-EC-D-Arm) vs. drei Zyklen 5-Fluorouracil+Epirubicin+Cyclophosphamid (FEC 100) q3w, gefolgt von drei Zyklen Docetaxel 100 q3w (Kontrollarm) [5]. Das Ziel der Studie war es, die Dosis im Anthrazyklin-/Taxan-Arm adjustiert an die auftretenden Toxizitäten zu eskalieren oder zu deeskalieren. Dies resultierte in einer höheren Dosis für Cyclophosphamid (120%) und Epirubicin (35%) sowie in einer Steigerung der nichthämatologischen Grad-3/4-Nebenwirkungen. Allerdings konnte im tdd-EC-D-Arm nach einem Follow-up von 5,3 Jahren im Vergleich zum Kontrollarm eine Verbesserung des Brustkrebs-spezifischen rezidivfreien Überlebens (BCRFS, primärer Endpunkt) von 3,7% (88,7% vs. 85%; Hazard Ratio = 0,79; 95-%-KI: 0,61–1,01; p = 0,062) gezeigt werden. Auch der sekundäre Endpunkt, das ereignisfreie Überleben (EFS), zeigte einen signifikanten Unterschied von 4,6% (86,7% vs. 82,1%; Hazard Ratio = 0,79; 95-%-KI: 0,63–0,99; p = 0,042). Interessant war darüber hinaus, dass das BCRFS von der verabreichten Dosis der tdd Chemotherapie unbeeinflusst blieb (Abb. 1).
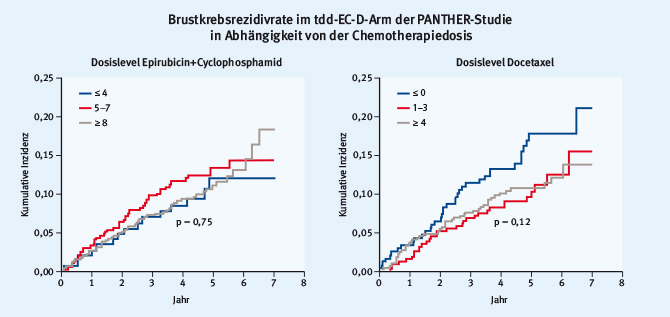 Abb. 1: Brustkrebs-spezifisches rezidivfreies Überleben (BCRFS) im tdd-EC-D-Arm der PANTHER-Studie in Abhängigkeit von der tdd (tailored dose dense) Chemotherapiedosis (modifiziert nach [5]).
Abb. 1: Brustkrebs-spezifisches rezidivfreies Überleben (BCRFS) im tdd-EC-D-Arm der PANTHER-Studie in Abhängigkeit von der tdd (tailored dose dense) Chemotherapiedosis (modifiziert nach [5]).Somit kann gefolgert werden, dass ein De- oder Eskalieren einer dosisdichten Anthrazyklin- und Taxan-haltigen Chemotherapie keinen Nachteil für unsere Patientinnen bedeutet und darüber hinaus die dosisdichte Chemotherapie weiterhin zum Standard gehört.
Fazit
- Sechs Zyklen Docetaxel+Cyclophosphamid (TC) sind vor allem bei den nodal-positiven, HR+-Tumoren mit ≥ 4 Lymphknoten im Vergleich zu einem TaxAC-Regime in der adjuvanten Therapie weniger effektiv.
- Die adjuvante dosisdichte Chemotherapie mit Epirubicin+Cyclophosphamid (EC) q2w, gefolgt von vier Zyklen tdd Docetaxel (D) q2w zeigt unabhängig von einer toxizitätsadjustierten Dosisanpassung gegenüber drei Zyklen FEC 100 q3w bessere Ergebnisse (BCRFS, EFS).
Endokrine Therapie des frühen Mammakarzinoms
Die Frage nach der optimalen Dauer einer endokrinen Therapie wird von unseren Patientinnen immer wieder gestellt und bewegt auch uns als Therapeuten. Wir wissen schließlich um die auch nach vielen Jahren noch auftretenden Spätrezidive der luminalen, HR-positiven Mammakarzinome. Durch die Daten der ATLAS- [6] und aTTom-Studie [7] konnte ein Überlebensvorteil mit einer zehnjährigen Tamoxifentherapie erreicht werden. Auf dem ASCO-Kongress in Chicago wurden nun die Ergebnisse der MA.17R-Studie vorgestellt, einer Phase-III-Studie, in der Patientinnen mit frühem HR-positiven Mammakarzinom nach einer bis zu fünfjährigen Tamoxifentherapie für 4,5–6 Jahre mit einem Aromatasehemmer behandelt und danach in fünf Jahre Letrozol vs. Placebo randomisiert wurden [8]. In die Studie wurden 1.918 Patientinnen eingebracht. Das Follow-up, dem die aktuelle Auswertung zugrunde lag, betrug 6,3 Jahre. Die Resultate wurden hochrangig in der Plenary Session vorgestellt und zeigten einen signifikanten Vorteil für die Verbesserung des krankheitsfreien Überlebens (DFS) von 95% vs. 91% durch eine zusätzliche fünfjährige Therapie mit Letrozol (Hazard Ratio = 0,66; p = 0,01). Ein signifikanter Vorteil für das Fünf-Jahres-Gesamtüberleben (OS) konnte jedoch nicht festgestellt werden (93% für den Placebo- vs. 94% für den Letrozol-Arm; Hazard Ratio = 0,97). Ein Grund für den fehlenden Überlebensvorteil ist sicherlich der hohe Anteil der kontralateralen Zweitkarzinome an den dokumentierten Events, welche um 58% gesenkt wurden (Hazard Ratio = 0,42; p = 0,007). Somit wurde zwar das DFS, nicht aber das OS gesenkt. Hinsichtlich der Nebenwirkungen konnte nach einer zusätzlichen fünfjährigen Therapie mit Letrozol eine Verdoppelung der neu aufgetretenen Osteoporosen (11% vs. 6%; p < 0,0001) und eine Erhöhung der Frakturrate von 9% auf 14% (p = 0,001) festgestellt werden. Ob wir unseren Patientinnen nun zukünftig zu einer 15-jährigen antihormonellen Therapie raten sollten, muss sicherlich individuell und je nach Therapieverträglichkeit entschieden werden.
Dennoch, die Präsentation von Hongchao Pan et al. von der Early Breast Cancer Trialists' Collaborative Group (EBCTCG) zum Langzeitrisiko nach fünfjähriger antihormoneller Therapie zeigte eindrücklich, dass das Risiko einer Fernmetastasierung eines Luminaltumors über die Jahre kontinuierlich anhält – eine Information, die wir an unsere Patientinnen weitergeben sollten und die sicherlich eine Diskussion über eine mögliche Therapieverlängerung nach sich ziehen mag (Abb. 2) [9].
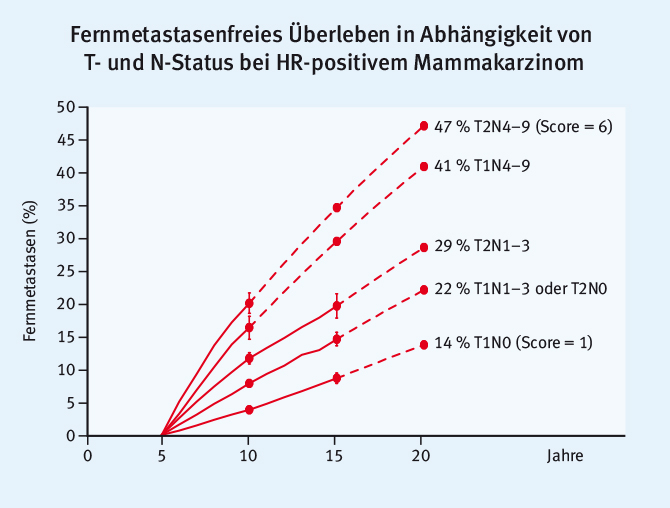 Abb. 2: Einfluss des T- und N-Status auf das fernmetastasenfreie Überleben bei HR-positivem Mammakarzinom (modifiziert nach [9]).
Abb. 2: Einfluss des T- und N-Status auf das fernmetastasenfreie Überleben bei HR-positivem Mammakarzinom (modifiziert nach [9]).Fazit
- Hormonrezeptor-positive, HER2-negative Mammakarzinome haben nach Absetzen einer fünfjährigen adjuvanten endokrinen Therapie ein weiterbestehendes kontinuierliches Fernmetastasenrisiko, welches auch nach 20 Jahren nicht nachlässt.
- Eine erweiterte adjuvante endokrine Therapie mit 15 Jahren Therapiedauer wie in der MA.17R-Studie hat demnach ihre Berechtigung. Sie sollte allerdings individuell und toxizitätsabhängig entschieden werden.
“Trotz einer fünfjährigen antiendokrinen Therapie besteht über die nächsten 20 Jahre hinweg ein kontinuierliches Fernmetastasenrisiko, sodass wir unseren Patientinnen auf individueller Basis unter Berücksichtigung der erhöhten Nebenwirkungen eine erweiterte adjuvante endokrine Therapie anbieten sollten.“ Priv.-Doz. Dr. med. Marc Thill
Endokrin-basierte Therapie des Hormonrezeptor-positiven metastasierten Mammakarzinoms
Nach den beeindruckenden Daten der PALOMA-1-Studie (Phase-II-Studie) [10] zum Einsatz des CDK 4/6-Inhibitors Palbociclib bei der Erstlinientherapie des metastasierten, HR-positiven, HER2-negativen Mammakarzinoms wurden die Daten der PALOMA-2-Studie (Phase-III-Studie) mit 666 Patientinnen zur Bestätigung der Phase-II-Studie mit Spannung erwartet. Tatsächlich konnten die Daten der PALOMA-2-Studie den Erfolg der PALOMA-1-Studie bestätigen und zeigten eine Verbesserung des PFS um zehn Monate (24,8 vs. 14,5 Monate; Hazard Ratio = 0,58; p < 0,000001) [11]. Nicht zuletzt aufgrund dieser Ergebnisse wird die Zulassung von Palbociclib, die wahrscheinlich in Deutschland für Dezember vorgesehen ist, schon mit Ungeduld erwartet.
In diesem Zusammenhang sind die Daten aus der PALOMA-3-Studie (Palbociclib+Fulvestrant nach Progress unter einer endokrinen Therapie in der metastasierten Situation oder innerhalb von zwölf Monaten nach adjuvanter Therapie) sehr interessant [12]. Die Autoren konnten zeigen, dass bei 27% der Patientinnen eine ESR1-Mutation nachzuweisen war, die allerdings nur nach Vorbehandlung durch einen Aromatasehemmer und nicht nach Vorbehandlung durch Tamoxifen auftrat. Das lässt die Hypothese zu, dass eine ESR1-Mutation stark mit einer nach Aromatasehemmer-Therapie erworbenen endokrinen Resistenz assoziiert ist. Vor diesem Hintergrund wäre ein Wechsel von einem auf einen anderen Aromatasehemmer generell nicht mehr sinnvoll. Vielmehr sollte ein Wechsel auf Palbociclib bevorzugt werden, welches eine vom ESR1-Status unabhängige Wirkung zeigte.
Fazit
- Die Inhibition der Cyclin-D-Kinasen 4/6 durch Palbociclib hat in den PALOMA-1- und -3-Studien und nun auch in der PALOMA-2-Studie konsistente Ergebnisse erzielt.
- Die Hemmung der CDK 4/6 ist die zurzeit effektivste Therapieoption zur Überwindung einer endokrinen Resistenz.
- ESR1-Mutationen entwickeln sich vor allem unter einer Aromataseinhibition, haben aber keinen Einfluss auf die Wirkung von Palbociclib.
„Die Daten der PALOMA-2-Studie mit einem Unterschied für das PFS von zehn Monaten haben mich tatsächlich beeindruckt. Dieses exzellente Ergebnis und die daraus resultierende Zulassung werden die Kombination aus Palbociclib und Letrozol zum neuen Standard in der Behandlung des Hormonrezeptor-positiven, HER2-negativen, fortgeschrittenen Mammakarzinoms machen“. Priv.-Doz. Dr. med. Marc Thill
Therapie des HER2-positiven, metastasierten Mammakarzinoms
Die PHEREXA-Studie ist eine Phase-III-Studie, die bei 452 Patientinnen mit metastasiertem HER2-positiven Mammakarzinom nach Progress unter oder nach einer Taxan-haltigen Chemotherapie in Kombination mit Trastuzumab die Strategie des "treatment beyond progression" (TBP) untersucht hat [13]. Die Patientinnen wurden in zwei Arme randomisiert und erhielten Trastuzumab+Capecitabin mit oder ohne Pertuzumab. Primärer Endpunkt war das PFS. Die Rationale für das Weiterführen einer HER2-gerichteten Therapie mit Trastuzumab in Kombination mit Capecitabin über die Progression hinaus wurde bereits in der GBG-26-Studie bestätigt [14]. Nun sollte die duale Blockade mit Trastuzumab und Pertuzumab einen weiteren Benefit generieren. Allerdings konnte durch die Hinzunahme von Pertuzumab das PFS nicht signifikant verbessert (9,0 vs. 11,1 Monate; Hazard Ratio = 0,82; 95-%-KI: 0,65–1,02; p = 0,07) und damit der primäre Endpunkt nicht erreicht werden. Augenscheinlich wirkt die Kombination der beiden Antikörper nach einer unter Trastuzumab progredienten HER2-positiven Erkrankung nicht auf die Art und Weise, wie es von der CLEOPATRA-Studie hätte erwartet werden können [15]. Obwohl man die beiden Studien nicht direkt vergleichen kann, muss berücksichtigt werden, dass in der CLEOPATRA-Studie in beiden Armen nur jeweils 10,0% und 11,7% der Patientinnen mit Trastuzumab vorbehandelt waren und die duale Blockade mit Docetaxel kombiniert wurde. Die nicht interventionelle HELENA-Studie soll aktuell die Effektivität von Docetaxel, Trastuzumab und Pertuzumab nach einer Trastuzumab-Vorbehandlung in der Erstlinientherapie des metastasierten HER2-positiven Mammakarzinoms klären.
Einsatz von Checkpoint-Inhibitoren beim metastasierten, tripel-negativen Mammakarzinom
Die Immuntherapie ist momentan in aller Munde und eine der ganz großen Hoffnungen in der Onkologie. Große Erfolge konnten bereits beim malignen Melanom oder Nierenzellkarzinom erreicht werden. Auch beim Mammakarzinom ist die Therapie daher unter intensiver Beforschung. Doch die Daten zum Einsatz einer Monotherapie mit PD1- oder PDL1-Inhibitoren sind im metastasierten Setting bisher enttäuschend, auch bei der mutagensten Subgruppe, dem tripel-negativen Mammakarzinom. So kann schon jetzt konstatiert werden, dass PD1- oder PDL1-Inhibitoren mit einem Chemotherapeutikum kombiniert werden sollten. Auf dem diesjährigen ASCO-Kongress wurden beispielsweise Resultate einer Phase-Ib-Studie mit der Kombination Atezolizumab (PDL1-Inhibitor) plus nab-Paclitaxel vorgestellt, die in der Erstlinientherapie eine Gesamtansprechrate von 46% und in der Drittlinientherapie sogar noch ein Ansprechen von 40% zeigten [16] (Tab. 1). nab-Paclitaxel hat gegenüber anderen Taxanen den Vorteil, dass es ohne Steroide verabreicht werden kann und man dadurch mögliche immunsuppressive Steroideffekte umgeht.
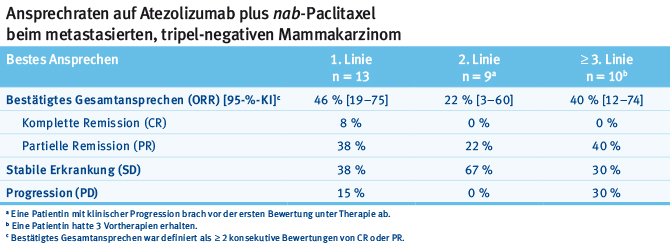 Tab. 1: Ansprechraten auf Atezolizumab plus nab-Paclitaxel beim metastasierten, tripel-negativen Mammakarzinom (Phase Ib) (modifiziert nach [16]).
Tab. 1: Ansprechraten auf Atezolizumab plus nab-Paclitaxel beim metastasierten, tripel-negativen Mammakarzinom (Phase Ib) (modifiziert nach [16]).Momentan laufen eine ganze Reihe von Studien, um den zukünftigen Stellenwert der Immuncheckpoint-Inhibitoren beim Mammakarzinom zu definieren. Erwähnenswert ist dabei sicherlich die IMpassion130-Phase-III-Studie, die Atezolizumab in Kombination mit nab-Paclitaxel bei 900 Patientinnen in der Erstlinientherapie des metastasierten tripel-negativen Mammakarzinoms überprüft [17].
Fazit
- Immuncheckpoint-Inhibitoren spielen bei der Therapie des Mammakarzinoms als Monosubstanz zurzeit keine relevante Rolle, sondern bedürfen eines Chemotherapeutikums als Partner.
- Der perfekte Partner für die Kombinationstherapie von PD1- und PDL1-Inhibitoren scheint nab-Paclitaxel zu sein.
- Laufende Studien, die die Kombination aus nab-Paclitaxel und dem PDL1-Inhibitor Atezolizumab überprüfen, sind in der neoadjuvanten Therapie die NEOTRIP-Studie und in der metastasierten Situation die IMpassion130.
Quellen
- Gianni L et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol 2012; 13: 25-32.
- Schneeweiss A et al. Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA). Ann Oncol 2013; 24: 2278-2284.
- Nitz U et al. Final analysis of WSG-ADAPT HER2+/HR- trial: Efficacy, safety, and predictive markers for 12-weeks of neoadjuvant dual blockade with trastuzumab + pertuzumab ± weekly paclitaxel in HER2+/HR- early breast cancer (EBC). J Clin Oncol 34, 2016 (suppl; abstr 518).
- Blum JL et al. Interim joint analysis of the ABC (anthracyclines in early breast cancer) phase III trials (USOR 06-090, NSABP B-46I/USOR 07132, NSABP B-49 [NRG Oncology]) comparing docetaxel + cyclophosphamide (TC) v anthracycline/taxane-based chemotherapy regimens (TaxAC) in women with high-risk, HER2-negative breast cancer. J Clin Oncol 34, 2016 (suppl; abstr 1000).
- Bergh JCS et al. PANTHER: Prospective randomized phase III trial of tailored and dose-dense versus standard tri-weekly adjuvant chemotherapy for high-risk breast cancer in the modern era of endocrine and anti-HER2 therapy. J Clin Oncol 34, 2016 (suppl; abstr 1002).
- Davies C et al. Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor-positive breast cancer: ATLAS, a randomised trial. Lancet 2013; 381: 805-816. Erratum in: Lancet 2013; 381: 804.
- Gray RG et al. aTTom: Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 in 6,953 women with early breast cancer. J Clin Oncol 31, 2013 (suppl; abstr 5).
- Goss PE et al. A randomized trial (MA.17R) of extending adjuvant letrozole for 5 years after completing an initial 5 years of aromatase inhibitor therapy alone or preceded by tamoxifen in postmenopausal women with early-stage breast cancer. J Clin Oncol 34, 2016 (suppl; abstr LBA1).
- Pan H et al. Predictors of recurrence during years 5-14 in 46,138 women with ER+ breast cancer allocated 5 years only of endocrine therapy (ET). J Clin Oncol 34, 2016 (suppl; abstr 505).
- Finn RS et al. The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomised phase 2 study. Lancet Oncol 2015; 16: 25-35.
- Finn RS et al. PALOMA-2: Primary results from a phase III trial of palbociclib (P) with letrozole (L) compared with letrozole alone in postmenopausal women with ER+/HER2– advanced breast cancer (ABC). J Clin Oncol 34, 2016 (suppl; abstr 507).
- Turner NC et al. Palbociclib in Hormone-Receptor-Positive Advanced Breast Cancer. N Engl J Med 2015; 373: 209-219.
- Urruticoechea A et al. PHEREXA: A phase III study of trastuzumab (H) + capecitabine (X) ± pertuzumab (P) for patients (pts) who progressed during/after one line of H-based therapy in the HER2-positive metastatic breast cancer (MBC) setting. J Clin Oncol 34, 2016 (suppl; abstr 504).
- von Minckwitz G et al. Trastuzumab beyond progression in human epidermal growth factor receptor 2-positive advanced breast cancer: a german breast group 26/breast international group 03-05 study. J Clin Oncol 2009; 27: 1999-2006.
- Swain SM et al. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA study): overall survival results from a randomised, double-blind, placebo-controlled, phase 3 study. Lancet Oncol 2013; 14: 461-471.
- Adams S et al. Phase Ib trial of atezolizumab in combination with nab-paclitaxel in patients with metastatic triple-negative breast cancer (mTNBC). J Clin Oncol 34, 2016 (suppl; abstr 1009).
- Emens LA et al. IMpassion130: a Phase III randomized trial of atezolizumab with nab-paclitaxel for first-line treatment of patients with metastatic triple-negative breast cancer (mTNBC). J Clin Oncol 34, 2016 (suppl; abstr TPS1104).
- Bildnachweis: „Skyscraper”: © katy_89/Fotolia
Aktuelle Ergebnisse der ETNA-Studie
ETNA (Evaluating Treatment with Neoadjuvant Abraxane), eine randomisierte Phase-III-Studie zum Vergleich von neoadjuvantem nab-Paclitaxel vs. Paclitaxel, jeweils gefolgt von einer Anthrazyklin-haltigen Chemotherapie bei Patientinnen mit HER2-negativem high-risk Mammakarzinom: Eine Michelangelo-Studie [1].
Priv.-Doz. Dr. med. Marc Thill, AGAPLESION Markus Krankenhaus, Frankfurt am Main
 nab-Paclitaxel ist als lösungsmittelfreie, kolloidale Suspension von Paclitaxel und humanem Serumalbumin seit 2008 in Europa als Monotherapie für die Behandlung von Patientinnen mit metastasiertem Mammakarzinom zugelassen, bei denen die First-Line-Therapie fehlgeschlagen ist und für die eine standardmäßige Anthrazyklin-haltige Therapie nicht angezeigt ist. In der aktuellen ETNA-Studie konnte nab-Paclitaxel die Rate pathologischer Komplettremissionen (pCR) gegenüber dem konventionellen Paclitaxel nicht signifikant verbessern. Es konnte allerdings ein Trend für eine bessere pCR unter nab-Paclitaxel in der ITT-Population gezeigt werden. In der multivariaten pCR-Analyse zeigte sich ein signifikanter Unterschied im Vergleich tripel-negatives Mammakarzinom versus Luminal-B-like-Mammakarzinom. Im Kontext mit den Daten der GeparSepto-Studie [2] muss jedoch festgestellt werden, dass zwischen beiden Studien relevante Unterschiede hinsichtlich Dosisintensität, Schedule und der Studienpopulation bestehen, die das Verfehlen des primären Endpunktes relativieren. Neben der unterschiedlichen Dosierung der beiden Taxane gibt es im Vergleich beider Studien zum Beispiel weitere relevante Differenzen, vor allem bezüglich der Risiken der jeweiligen Patientinnenkollektive. Wie sind diese Unterschiede zu bewerten?
nab-Paclitaxel ist als lösungsmittelfreie, kolloidale Suspension von Paclitaxel und humanem Serumalbumin seit 2008 in Europa als Monotherapie für die Behandlung von Patientinnen mit metastasiertem Mammakarzinom zugelassen, bei denen die First-Line-Therapie fehlgeschlagen ist und für die eine standardmäßige Anthrazyklin-haltige Therapie nicht angezeigt ist. In der aktuellen ETNA-Studie konnte nab-Paclitaxel die Rate pathologischer Komplettremissionen (pCR) gegenüber dem konventionellen Paclitaxel nicht signifikant verbessern. Es konnte allerdings ein Trend für eine bessere pCR unter nab-Paclitaxel in der ITT-Population gezeigt werden. In der multivariaten pCR-Analyse zeigte sich ein signifikanter Unterschied im Vergleich tripel-negatives Mammakarzinom versus Luminal-B-like-Mammakarzinom. Im Kontext mit den Daten der GeparSepto-Studie [2] muss jedoch festgestellt werden, dass zwischen beiden Studien relevante Unterschiede hinsichtlich Dosisintensität, Schedule und der Studienpopulation bestehen, die das Verfehlen des primären Endpunktes relativieren. Neben der unterschiedlichen Dosierung der beiden Taxane gibt es im Vergleich beider Studien zum Beispiel weitere relevante Differenzen, vor allem bezüglich der Risiken der jeweiligen Patientinnenkollektive. Wie sind diese Unterschiede zu bewerten?
Hintergrund
Der Einsatz von neoadjuvanten Chemotherapieregimen, die Anthrazykline und Taxane beinhalten, hat zu einer Verdopplung der pathologischen Komplettremission (pCR) geführt. Mittlerweile hat sich die Evidenz verdichtet, dass eine pCR – zumindest bei der Therapie des tripel-negativen Mammakarzinoms und in Kombination mit einer HER2-gerichteten Therapie – auch bei der HER2-positiven Patientenpopulation mit einem Überlebensvorteil assoziiert ist [3].
nab-Paclitaxel ist ein eine lösungsmittelfreie, kolloidale Suspension von Paclitaxel und humanem Serumalbumin, die in Europa seit 2008 als Monotherapie für die Behandlung von Patientinnen mit metastasiertem Mammakarzinom, bei denen die First-Line-Therapie fehlgeschlagen ist und für die eine standardmäßige Anthrazyklin-haltige Therapie nicht angezeigt ist, zugelassen ist. Aufgrund der Nanopartikelformulierung benötigt nab-Paclitaxel keinen Lösungsvermittler und daher auch keine Prämedikation zur Prophylaxe schwererer Hypersensitivitätsreaktionen.
In der GeparSepto-Studie wurde nab-Paclitaxel bereits in der neoadjuvanten Therapie eingesetzt und konnte im Vergleich zu lösungsvermitteltem Paclitaxel zu einer signifikanten Steigerung der pCR führen [2].
Methoden
Die ETNA-Studie ist eine prospektiv randomisierte, multinationale, multizentrische Studie, die in Zusammenarbeit mit den Studiengruppen GEICAM und BCRC-WA durchgeführt wurde. In die Studie wurden 695 zentral getestete HER2-negative Patientinnen eingebracht, die in tripel-negativ und luminal-B-like stratifiziert wurden. Eingeschlossen werden konnten alle Patientinnen mit tripel-negativem Tumor und einem Tumorstadium cT2-cT4 sowie Hormonrezeptor-positive Patientinnen mit Tumorstadium cT2-cT4, G2-3. Dabei wurde unterschieden in luminal-B-like high (ER und/oder PR >= 1%, Ki67 > 20%) und luminal-B-like intermediate (Ki67 zwischen 14–20%). Die Patientinnen erhielten nab-Paclitaxel 125 mg/m² (n = 346) oder Paclitaxel 90 mg/m² (n = 349). Beide Chemotherapeutika wurden im 3/4-Takt gegeben. Das heißt, dass die Applikation in Woche 1, 2 und 3 mit Pause in Woche 4 erfolgte. Im Anschluss daran erhielten die Patientinnen vier Zyklen einer Anthrazyklin-haltigen Therapie nach Wahl des Therapeuten (EC, AC oder FEC) (Abb. 1).
 Abb. 1: Studiendesign der ETNA-Studie (modifiziert nach [1]).
Abb. 1: Studiendesign der ETNA-Studie (modifiziert nach [1]).Der primäre Endpunkt war das Erreichen der pCR (tpCR: kein Tumorresiduum in der Brust und den axillären Lymphknoten). Einer der sekundären Endpunkte war der separate Vergleich der pCR bei tripel-negativen und luminal-B-like Tumoren.
Ergebnisse
Die pCR in der ITT-Population lag für nab-Paclitaxel bei 22,5% (95-%-KI 18,2–27,3) vs. 18,6% (95-%-KI 14,7–23,1) für Paclitaxel (OR 0,77; 95-%-KI 0,52–1,13; p = 0,1858). Damit verfehlte die Studie ihren primären Endpunkt, einen Unterschied von absoluten 10% hinsichtlich der pCR zu erreichen. Im Vergleich der Subgruppen untereinander konnte bei den tripel-negativen Patientinnen eine pCR von 41,3% für nab-Paclitaxel vs. 37,3% für Paclitaxel festgestellt werden (OR 0,85; 95-%-KI 0,49–1,45), darüber hinaus für die Luminal-B-like-Tumoren von 13,9% für nab-Paclitaxel und von 10,0% für Paclitaxel (OR 0,69; 95-%-KI 0,39–1,21) (Tab. 1). In der multivariaten Analyse der pCR war der Unterschied zwischen der tripel-negativen und der Luminal-B-like-Gruppe mit einer Odds Ratio von 4,85 (95-%-KI 3,28–7,18) signifikant (p < 0,0001). In der Subgruppenanalyse konnte bei allen Subgruppen ein Vorteil für den Einsatz von nab-Paclitaxel verzeichnet werden.
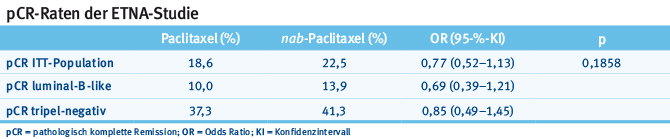 Tab. 1: pCR-Raten der ETNA-Studie (modifiziert nach [1]).
Tab. 1: pCR-Raten der ETNA-Studie (modifiziert nach [1]).Hinsichtlich der Nebenwirkungen wurde unter nab-Paclitaxel bei 16% der Patientinnen und unter Paclitaxel bei 11% der Patientinnen mindestens ein schweres Adverse Event dokumentiert. Die für unsere Patientinnen relevante periphere Neuropathie Grad 3/4 trat im nab-Paclitaxel-Arm in 4,5% und im Paclitaxel-Arm in 1,8% auf.
Diskussion
Dass der primäre Endpunkt (absolute Erhöhung der pCR unter nab-Paclitaxel um 10%) nicht erreicht wurde, überrascht zunächst. Schließlich konnte in der GeparSepto-Studie ein absoluter Unterschied von 9% (38% vs. 29%, Odds Ratio 1,53; p = 0,00065) gezeigt werden und damit eine signifikante Verbesserung der pCR durch den Einsatz von nab-Paclitaxel im Vergleich zu lösungsmittelbasiertem Paclitaxel [2]. Da aber ein direkter Vergleich beider Studien nicht möglich ist, lohnt es sich, einen genaueren Blick auf die Studien zu werfen.
Zunächst einmal wurden in die ETNA-Studie 695 Patientinnen und in die GeparSepto-Studie 1.206 Patientinnen eingebracht. Somit besteht die Möglichkeit, dass die ETNA-Studie für das Präsentieren eines signifikanten Unterschieds nicht genügend gepowert war. Neben einer fehlenden statistischen Power können vor allem das Patientinnenkollektiv sowie die unterschiedlichen Schedules und kumulativen Dosen von nab-Paclitaxel und Paclitaxel für die im Vergleich zur GeparSepto-Studie unterschiedlichen Ergebnisse und das Verfehlen des primären Endpunkts im Rahmen der ETNA-Studie verantwortlich sein.
In der GeparSepto-Studie wurde nab-Paclitaxel mit einer Dosis von 125 mg/m² wöchentlich innerhalb von zwölf Wochen appliziert und damit in einem dosisdichten/dosisintensivierten Schedule gegeben. In der ETNA-Studie hingegen wurde nab-Paclitaxel mit derselben Dosis von 125 mg/m² in einem intermittierenden Schedule wöchentlich für drei Wochen mit danach einer Woche Pause (3/4-Takt) insgesamt über 16 Wochen appliziert. Das führt dazu, dass zwar die infundierte Gesamtdosis von nab-Paclitaxel von 1.500 mg in beiden Studien identisch ist, durch die verschiedenen Schedules die Dosisintensität pro Woche allerdings unterschiedlich (125 mg vs. 93,75 mg). Somit wurde in der GeparSepto-Studie eine um 31,25 mg höhere wöchentliche nab-Paclitaxel-Dosis appliziert. Ähnlich verhält es sich mit dem konventionellen Paclitaxel. In der GeparSepto-Studie wurden 80 mg/m² wöchentlich, in der ETNA-Studie 90 mg/m² im 3/4-Takt gegeben. In der ETNA-Studie führte dies zu einer höheren Kumulativdosis von 1.080 mg vs. 960 mg in der GeparSepto-Studie. Allerdings ist auch hier die Dosisintensität mit 80 mg/Woche in der GeparSepto-Studie höher als in der ETNA-Studie mit 67,5 mg/Woche (Tab. 2).
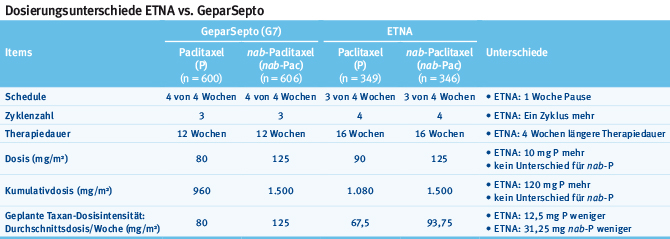 Tab. 2: Dosierungsunterschiede ETNA vs. GeparSepto (modifiziert nach [1]).
Tab. 2: Dosierungsunterschiede ETNA vs. GeparSepto (modifiziert nach [1]).Neben der unterschiedlichen Dosierung der beiden Taxane gibt es im Vergleich beider Studien weitere relevante Differenzen, vor allem bezüglich der Patientinnenpopulation. So weist das Patientinnenkollektiv der ETNA-Studie ein geringeres Risiko als das der GeparSepto-Studie auf. Insgesamt betrug der Anteil der Luminal-B-like-Tumoren in der ETNA-Studie 68,5%, während er in der GeparSepto-Studie bei 44,0% lag. Darüber hinaus gingen in die GeparSepto-Studie auch HER2-positive Patientinnen (33%) ein, die in die ETNA-Studie nicht eingeschlossen wurden. Der Anteil der tripel-negativen Patientinnen lag in der GeparSepto-Studie bei 23%, verglichen mit 31,5% in der ETNA-Studie.
Da für Luminal-B-like-Tumoren im Vergleich mit tripel-negativen oder HER2-positiven Tumoren eine geringere pCR zu erwarten ist und der Anteil der Luminal-B-like-Tumoren in der ETNA-Studie um 24,5% höher ist als in der GeparSepto-Studie, ist dies eine relevante Einflussgröße auf die pCR.
Folglich ist das geringere Risiko der Patientinnen in der ETNA-Studie und der höhere Anteil an Luminal-B-like-Tumoren mit einer pCR von nur 13,9% für nab-Paclitaxel und 10% für Paclitaxel verantwortlich für die im Vergleich zur GeparSepto-Studie deutlich niedrigere pCR.
Fazit
- nab-Paclitaxel zeigte in der ETNA-Studie für die ITT-Population einen Trend zu einer erhöhten pCR-Rate gegenüber konventionellem Paclitaxel (3,9% Unterschied, nicht signifikant).
- Die multivariate Analyse der pCR zeigte einen signifikanten Unterschied zwischen der tripel-negativen und der Luminal-B-like-Gruppe.
- Im Kontext mit den Daten der GeparSepto-Studie muss jedoch konstatiert werden, dass zwischen beiden Studien relevante Unterschiede hinsichtlich Dosisintensität, Schedule und der Studienpopulation bestehen, die das Verfehlen des primären Endpunktes erklären können.
- Es muss geschlussfolgert werden, dass nab-Paclitaxel für die neoadjuvante Therapie des frühen Mammakarzinoms in einer Dosis von 125 mg/m² wöchentlich und ohne Pause eingesetzt werden sollte.
„Für mich ist die ETNA-Studie eine eminent wichtige Studie, da sie uns gezeigt hat, dass nab-Paclitaxel eine hocheffektive Substanz ist, die in der neoadjuvanten Situation besser in einem dosisintensivierten Schedule von 125 mg/m² wöchentlich und insgesamt für zwölf Wochen eingesetzt werden sollte.“ Priv.-Doz. Dr. med. Marc Thill
Quellen
- Gianni L et al. ETNA (Evaluating Treatment with Neoadjuvant Abraxane) randomized phase III study comparing neoadjuvant nab-paclitaxel (nab-P) versus paclitaxel (P) both followed by anthracycline regimens in women with HER2-negative high-risk breast cancer: A MICHELANGO study. J Clin Oncol 34, 2016 (suppl; abstr 502).
- Untch M et al. Nab-paclitaxel versus solvent-based paclitaxel in neoadjuvant chemotherapy for early breast cancer (GeparSepto-GBG 69): a randomised, phase 3 trial. Lancet Oncol 2016; 17: 345-356.
- Cortazar P et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet 2014; 384: 164-172.
- Bildnachweis: „Chicago skyline and Buckingham Fountain, USA”: © vlad_g/Fotolia
Nichtkleinzelliges Lungenkarzinom (NSCLC): personalisierte Therapieansätze nehmen weiter an Bedeutung zu
Dr. med. Akin Atmaca, Krankenhaus Nordwest, Frankfurt am Main
 Das nichtkleinzellige Lungenkarzinom (NSCLC) ist der Prototyp unter den soliden Tumoren mit zunehmend personalisiertem Therapieansatz. In relativ kurzer Zeit kam es durch die Entdeckung von bedeutenden genetischen Veränderungen, die als Treibermutationen bezeichnet werden, sehr schnell zur Implementierung personalisierter Therapieansätze mit sogenannten „targeted drugs“. Auch die diesjährige Jahrestagung der American Society of Clinical Oncology (ASCO) war vor allem von Entwicklungen und Neuerungen auf dem Gebiet der zielgerichteten molekularen Therapie geprägt, aber auch von immuntherapeutischen Ansätze mit den sogenannten „Checkpoint-Inhibitoren“.
Das nichtkleinzellige Lungenkarzinom (NSCLC) ist der Prototyp unter den soliden Tumoren mit zunehmend personalisiertem Therapieansatz. In relativ kurzer Zeit kam es durch die Entdeckung von bedeutenden genetischen Veränderungen, die als Treibermutationen bezeichnet werden, sehr schnell zur Implementierung personalisierter Therapieansätze mit sogenannten „targeted drugs“. Auch die diesjährige Jahrestagung der American Society of Clinical Oncology (ASCO) war vor allem von Entwicklungen und Neuerungen auf dem Gebiet der zielgerichteten molekularen Therapie geprägt, aber auch von immuntherapeutischen Ansätze mit den sogenannten „Checkpoint-Inhibitoren“.
Molekulare Testung: Die CRISP-Studie
Im Hinblick auf die Abbildung der Versorgungsrealität des metastasierten NSCLC in Deutschland wird die CRISP-Studie, die von Frank Griesinger als Poster in der Rubrik „trials in progress“ vorgestellt wurde, einen wichtigen Beitrag leisten [1]. Im Zentrum der Studie stehen vor allem die molekulare Testung und das Outcome dieser Patienten. Zum Zeitpunkt der Präsentation wurden in der bisher kurzen Zeit seit Studieninitiierung (der erste Patient wurde im Dezember 2015 eingeschlossen) bereits 133 Patienten in 33 Zentren erfasst.
Immuncheckpoint-Inhibitoren
Auch dieses Jahr standen wieder Therapiestudien mit PD-1/PD-L1-Antikörpern, den sogenannten Immuncheckpoint-Inhibitoren, im Fokus. Zum einen wurden Updates der bisherigen Studienergebnisse und Subgruppenanalysen hinsichtlich des Biomarkers PD-L1 präsentiert, zum anderen gab es einen Ausblick auf die weitere Entwicklung in der Erstlinientherapie, unter anderem in Kombination mit Chemotherapie und weiteren immunologisch relevanten Zielstrukturen.
Atezolizumab
Mit dem PD-L1-Antikörper Atezolizumab, der vor kurzem in den USA zur Behandlung des metastasierten Urothelkarzinoms zugelassen wurde, sind für die Erstlinientherapie des metastasierten NSCLC derzeit vier große Phase-III-Studien initiiert, für die momentan noch Patienten rekrutiert werden (IMPOWER 130, 131,132 und 150). In den hier vorgestellten Studien (Rubrik „trials in progess“) werden zum einen die Kombination der Standard-Platin-Dublette +/- Atezolizumab bei nicht-plattenepithelialen (nicht-squamös) und plattenepithelialen (squamös) NSCLC untersucht, zum anderen bei den nicht-plattenepithelialen Tumoren auch die zusätzliche VEGF-Blockade mit Bevacizumab in Kombination mit einer PD-L1-Blockade [2]. Als Haupt-„Backbone-Chemotherapie“ kommt hier der Kombination aus Carboplatin und nab-Paclitaxel besondere Aufmerksamkeit zu, nicht zuletzt aufgrund des geringeren Steroidbedarfs im Rahmen der Supportivtherapie, was sich günstig auf die Kombination mit einer Immuntherapie auswirkt.
Pembrolizumab
Für den PD-1-Antikörper Pembrolizumab, für den noch dieses Jahr in Deutschland die Zulassung für die Zweitlinientherapie von Patienten mit fortgeschrittenem NSCLC erwartet wird, wurden ebenfalls weiterführende Daten vorgestellt. In einer Subgruppenanalyse der Keynote-010-Studie (randomisierte Studie Pembrolizumab vs. Docetaxel), die von Baas in einem Poster vorgestellte wurde, zeigte sich eine eindeutige Assoziation der PD-L1-Expression mit der Ansprechrate (overall response rate; ORR) und dem Gesamtüberleben (OS) [3]. ORR beziehungsweise medianes OS lagen in der Pembrolizumab-Gruppe bei niedriger PD-L1-Expression (1%–24%) bei 8,6% beziehungsweise 9,7 Monaten, bei hoher PD-L1-Expression (≥ 75%) bei 33,7% beziehungsweise 16,6 Monaten. Eine statistisch signifikant bessere Ansprechrate gegenüber Docetaxel zeigte sich ab einer PD-L1-Expression von > 50%.
Aus der Keynote-001 liegen nun auch einige Langzeitüberlebenszeiten vor. Bei nicht vorbehandelten Patienten mit metastasiertem NSCLC liegen hier mediane Überlebenszeiten von 22,1 Monaten vor [4]!
In der Pembrolizumab-Erstlinienstudie (Keynote-021) konnten in verschiedenen Kohorten (Chemotherapie+Pembrolizumab +/- Bevacizumab) bisher 74 Patienten eingeschlossen werden [5]. Es wurden beeindruckende ORR bis zu 71% (48%–71%) beobachtet. Hierbei zeigte sich aber auch, dass bei PD-L1-negativen Patienten ähnlich hohe Ansprechraten erreicht werden konnten (fraglicher Nutzen des Biomarkers in diesem Setting?).
Eine Phase-III-Studie mit Cis/Carbo+Pemetrexed+Pembrolizumab vs. Cis/Carbo+Pem+Placebo (jeweils mit Erhaltung Pem+Pembro oder Pem+Placebo) ist bereits initiiert [6].
Nivolumab
Es wurden verschiedene Post-hoc-Analysen aus den Zulassungsstudien (CheckMate 017/057) der bereits zugelassenen Substanz „Nivolumab“ vorgestellt, eine davon bezüglich der prädiktiven Wertigkeit eines Zytokinprofils [7]. Sowohl bei den squamösen (SQ) als auch den nicht-squamösen (NSQ) Patienten war dieses Zytokinprofil „Cytoscore high“ vs. „Cytoscore low“ mit einem längeren medianen Überleben assoziiert (SQ: 15,6 vs. 5,3 Monate, p < 0,0001; NSQ: 17,9 vs. 5,9 Monate, p < 0,0001). Allerdings scheint dies eher von prognostischer Bedeutung zu sein und weniger prädiktiv, da auch im Chemotherapie-Arm die Überlebensdaten in der „Cytoscore high“-Gruppe besser waren. Diese Ergebnisse müssen weiter in einem prospektiven Setting validiert werden.
Durvalumab
Mit Durvalumab, einem weiteren PD-L1-Antikörper, wurden Daten von nicht vorbehandelten Stadium-IIIB/IV-Patienten vorgestellt (n = 59) [8]. Es zeigte sich eine ORR von 27% (nicht-squamös 27%, squamös 28%) (Tab. 1). Das Nebenwirkungsprofil lag im akzeptablen Bereich.
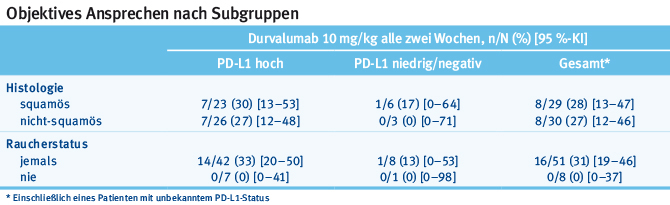 Tab. 1: Durvalumab bei Patienten mit nicht vorbehandeltem Stadium-IIIB/IV-NSCLC: objektives Ansprechen nach Subgruppen (modifiziert nach [8]).
Tab. 1: Durvalumab bei Patienten mit nicht vorbehandeltem Stadium-IIIB/IV-NSCLC: objektives Ansprechen nach Subgruppen (modifiziert nach [8]).Avelumab
Bei 145 nicht vorbehandelten NSCLC-Patienten konnte mit Avelumab in dieser Studie eine ORR von 18% in einem nicht selektionierten Patientenkollektiv (PD-L1-positiv und -negativ) gezeigt werden [9].
Ausblick Immuntherapie
Die Aktivierung des costimulatorischen Rezeptors OX40 führt zum verstärkten T-Zell-Priming und zu einer Generierung von Memory-T-Zellen, außerdem führt sie zu einer PD-L1-Induktion. Die Kombination des OX40-Agonisten MOXR0916 mit Atezolizumab zeigt eine klinische Aktivität bei verschiedenen soliden Tumoren, unter anderem auch beim NSCLC [10]. In Expansionskohorten werden weitere Effektivitätsdaten untersucht.
Eine weitere interessante Kombination besteht in der epigenetischen Modifikation in Kombination mit der PD1/PD-L1-Blockade. Durch eine verstärkte Neoepitop-Präsentation könnte die Wirksamkeit einer PD-1-Blockade verbessert werden oder bei Patienten, die von einer alleinigen PD1-Hemmung nicht profitieren, eine Immunantwort erst generiert werden. Hier ist eine randomisierte Phase-II-Studie mit dem oralen Azacitidin CC-486 in Kombination mit Pembrolizumab vs. Pembrolizumab+Placebo in Planung [11].
Fazit
- Zur Untersuchung von Atezolizumab für die Erstlinientherapie des metastasierten NSCLC sind derzeit vier große Phase-III-Studien initiiert. Als Haupt-„Backbone-Chemotherapie“ kann in diesem Setting die Kombination aus nab-Paclitaxel+Carboplatin betrachtet werden.
- Unter dem PD-1-Antikörper Pembrolizumab können beeindruckende Ansprechraten beobachtet werden – sowohl bei PD-L1-positiven als auch bei PD-L1-negativen Patienten.
- Unter Durvalumab zeigte sich bei NSCLC-Patienten im Stadium-IIIB/IV eine ORR von 27%.
- Bei NSCLC-Patienten, die mit Avelumab behandelt wurden, wurde eine ORR von 18% beobachtet.
- Die Kombination des OX40-Agonisten MOXR0916 mit Atezolizumab zeigt eine klinische Aktivität – auch beim NSCLC.
- Eine randomisierte Phase-II-Studie mit dem oralen Azacitidin CC-486 in Kombination mit Pembrolizumab vs. Pembrolizumab+Placebo für Patienten mit NSCL ist in Planung.
"Die Entwicklung bei den Checkpoint-Inhibitoren beim NSCLC verläuft rasant. Vorläufige Daten aus dem First-Line-Setting sind vielversprechend, sodass die Implementierung und Zulassung der PD-1/PD-L1-Antikörper in die First-Line-Therapie (z. B. in Kombination mit Chemotherapie) relativ kurzfristig zu erwarten sind.“ Dr. Akin Atmaca
Treibermutationen
EGFR-Mutation
Wakelee stellte eine Studie vor, bei der die Genotypisierung bezüglich der T790M-Mutation aus Tumorgewebe, Blutplasma und Urin unter der Behandlung mit dem Drittgenerations-EGFR-TKI Rociletinib untersucht wurde [12]. Es zeigte sich, dass die Bestimmung von T790M aus allen drei Testverfahren möglich ist (sich zum Teil ergänzend). Die Ansprechrate war ähnlich – unabhängig vom Testverfahren, mit dem die T790M Mutation nachgewiesen wurde (Tab. 2). Damit ist prinzipiell die Bestimmung der T790M-Mutation alternativ aus Blutplasma oder Urin möglich.
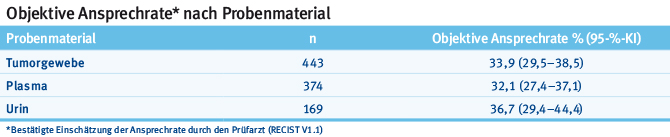 Tab. 2: Die bestätigte Einschätzung der Ansprechrate durch den Prüfarzt ist bei T790M-positiven Patienten, deren Mutation im Plasma, Tumorgewebe oder Urin nachgewiesen wurde, ähnlich (modifiziert nach [12]).
Tab. 2: Die bestätigte Einschätzung der Ansprechrate durch den Prüfarzt ist bei T790M-positiven Patienten, deren Mutation im Plasma, Tumorgewebe oder Urin nachgewiesen wurde, ähnlich (modifiziert nach [12]).Eine zerebrale und leptomeningeale Metastasierung bei Patienten mit aktivierender EGFR-Mutation unter EGFR-TKI stellt eine klinisch wichtige und schwierige Behandlungssituation dar. Mit dem ZNS-gängigen neuen EGFR-TKI AZD3759 und dem bereits zugelassenen Drittgenerations-EGFR-TKI Osimertinib wurde jetzt diese Behandlungssituation jeweils in einer Phase-I-Studie weiter untersucht [13, 14]: Unter AZD3759 bildete sich bei elf von 21 Patienten eine messbare zerebrale Metastasierung zurück. In der Parallelstudie, in der Patienten mit leptomeningealer Metastasierung mit Osimertinib behandelt wurden, konnte bei insgesamt 21 Patienten in sieben Fällen eine bestätigte radiologische Rückbildung erreicht werden, in zwei Fällen eine bestätigte Elimination der Tumorzellen im Liquor und in fünf Fällen eine signifikante Verbesserung neurologischer Symptome. Mit diesen vorläufigen, aber vielversprechenden Effektivitätsdaten werden beide Teilstudien weitergeführt.
ALK-Translokation
Auch bei den Patienten mit ALK-Translokation gibt es neue, vielversprechende Ergebnisse mit neueren Substanzen. Kim et al stellten eine randomisierte Phase-II-Studie (ALTA-Studie) mit Patienten mit Crizotinib-refraktärer Erkrankung vor, mit zwei unterschiedlichen Dosierungen von Brigatinib [15]. Insgesamt wurden 222 Patienten eingeschlossen, 112 in der 90-mg-Kohorte und 110 in der 180-mg-Kohorte. Die ORR war mit 45% beziehungsweise 54% bemerkenswert, bei einer "disease control rate" (DCR) von 82% beziehungsweise 86%. Das mediane progressionsfreie Überleben (PFS) in der 180-mg-Kohorte betrug zum jetzigen Auswertungszeitpunkt mindestens 12,9 Monate, das mediane Gesamtüberleben war in beiden Armen noch nicht erreicht (1-Jahres-Überlebensrate von 71% bzw. 80%). Bei intrakraniellen Metastasen zeigte sich eine ORR von 31% (mit 90 mg) beziehungsweise 67% (mit 180 mg). Die Verträglichkeit war in beiden Armen akzeptabel, eine randomisierte Studie mit 180 mg Brigatinib versus Crizotinib ist geplant.
Eine weitere Studie in diesem Setting mit sehr interessanten Ergebnissen war die J-ALEX-Studie, die von Nokihara vorgestellt wurde [16]: ein Head-to-Head-Vergleich von Alectinib und Crizotinib bei Patienten mit ALK-positivem NSCLC ohne TKI-Vorbehandlung. Insgesamt wurden 207 Patienten randomisiert (103 im Alectinib-Arm und 104 im Crizotinib-Arm). Unter Alectinib wurden signifikant weniger Grad-3/4-Toxizitäten beobachtet (26% vs. 52%). Die Ansprechrate betrug bei Alectinib 85,4% vs. 70,2% mit Crizotinib. Hinsichtlich des PFS war Alectinib dem Crizotinib signifikant überlegen (HR 0,34; medianes PFS unter Crizotinib: 10,2 Monate; unter Alectinib: not reached) (Abb. 1). Obwohl diese Studie nur bei einem asiatischen Kollektiv durchgeführt wurde, könnte sich Alectinib auch wegen der besseren Verträglichkeit in der Erstlinientherapie des ALK-positiven NSCLC durchsetzen!
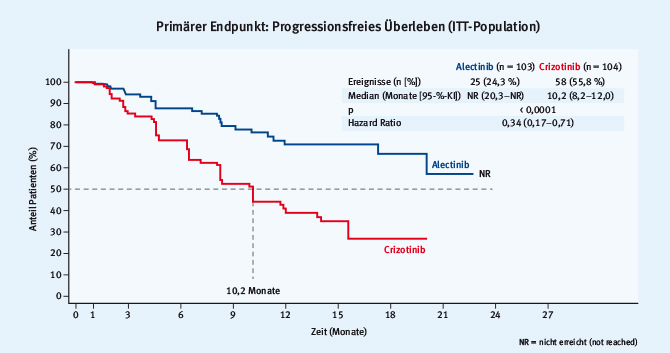 Abb. 1: Alectinib vs. Crizotinib bei Patienten mit ALK-positivem NSCLC ohne TKI-Vorbehandlung: Signifikante Überlegenheit von Alectinib gegenüber Crizotinib hinsichtlich des progressionsfreien Überlebens (modifiziert nach [16]).
Abb. 1: Alectinib vs. Crizotinib bei Patienten mit ALK-positivem NSCLC ohne TKI-Vorbehandlung: Signifikante Überlegenheit von Alectinib gegenüber Crizotinib hinsichtlich des progressionsfreien Überlebens (modifiziert nach [16]).Auch für Lorlatinib, einem weiteren Drittgenerations-ALK-Inhibitor mit Wirksamkeit bei den bisher bekannten Resistenzmutationen, wurden vielversprechende Daten vorgestellt [17]. In einer Dosiseskalationsstudie wurden insgesamt 54 Patienten eingeschlossen. Bei 41 mit ALK-TKI vorbehandelten Patienten zeigte sich eine ORR von 46% bei einem medianen PFS von 11,4 Monaten. Auch bei intrakraniellen Metastasen zeigte sich eine hohe Wirksamkeit mit einer ORR von 39%. Die Substanz wurde insgesamt gut toleriert, höhergradige Toxizitäten zeigten sich nur bezüglich einer Hypercholesterinämie.
VEGF-Inhibition
Cortot stellte die sogenannte Ultimate-Studie vor – eine randomisierte Phase-III-Studie mit Paclitaxel+Bevacizumab vs. Docetaxel [18]. Die Ansprechrate war im Kombinationsarm signifikant besser (22,5% vs. 5,5%), ebenso das PFS mit 5,4 vs. 3,9 Monate (HR: 0,62; 95-%-KI: 0,44–0,86, p = 0,005) (Abb. 2). Einen Unterschied im Gesamtüberleben konnte die Studie nicht zeigen, allerdings handelte es sich auch um ein Cross-over-Design. Erwartungsgemäß war das Toxizitätsprofil unterschiedlich, mit signifikant mehr Neutropenien, febrilen Neutropenien und Thrombozytopenien im Docetaxel-Arm und mehr Neuropathien und VEGF-spezifischen Nebenwirkungen im Paclitaxel+Bevacizumab-Arm.
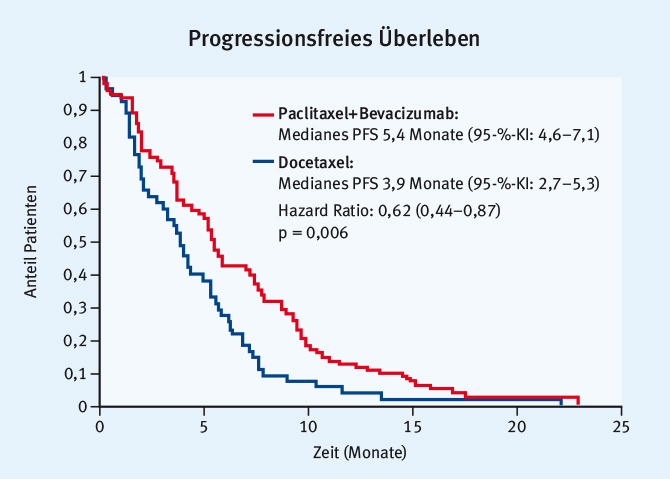 Abb. 2: Paclitaxel+Bevacizumab vs. Docetaxel: Signifikante Überlegenheit von Paclitaxel+Bevacizumab hinsichtlich des progressionsfreien Überlebens (modifiziert nach [18]).
Abb. 2: Paclitaxel+Bevacizumab vs. Docetaxel: Signifikante Überlegenheit von Paclitaxel+Bevacizumab hinsichtlich des progressionsfreien Überlebens (modifiziert nach [18]).Fazit
- Neben dem Nachweis einer T790M-Mutation im Tumorgewebe ist die Bestimmung alternativ auch im Blutplasma oder im Urin möglich.
- Bei zerebraler und leptomeningealer Metastasierung bei NSCLC-Patienten mit aktivierender EGFR-Mutation unter EGFR-TKI können mit den ZNS-gängigen EGFR-TKI AZD3759 und Osimertinib vielversprechende Behandlungsergebnisse erreicht werden.
- Brigatinib, Alectinib und Lorlatinib sind bei NSCLC-Patienten mit ALK-Translokation wirksame Substanzen.
- Paclitaxel+Bevacizumab zeigt im Vergleich zu Docetaxel eine signifikante Überlegenheit hinsichtlich des progressionsfreien Überlebens bei Patienten mit NSCLC.
„Das Portfolio an ‚targeted drugs‘ für EGFR-Mutationen und ALK-Translokation wird bedeutsam erweitert, vor allem durch Substanzen, die bei bisher bekannten Resistenzen noch wirken und eine gute ZNS-Penetrationsfähigkeit besitzen. Damit stehen – sehr praxisrelevant – mehrere Substanzen für schwierige Behandlungssituationen wie erworbene Resistenz und ZNS-Progress zur Verfügung.“ Dr. Akin Atmaca
Neue Substanzen
Camidge stellte eine Studie mit dem Anti-Trop-2SN-Antikörper-Chemotherapeutikum-Konjugat Sacituzumab govitecan (IMMU-132) vor, einem Vertreter der neuen Substanzklasse der Immuntoxine [19]. Insgesamt wurden in diese Studie bisher 54 Patienten mit NSCLC eingeschlossen. Bei den aktuell auswertbaren 46 Patienten zeigten sich zwölf partielle Remissionen (Ansprechrate 26%) (Abb. 3), ein medianes PFS von 3,9 Monaten und ein medianes OS von 10,5 Monaten. Eine Wirksamkeit zeigte sich bei allen Histologien, auch bei Patienten nach PD1/PD-L1-Antikörper-Vortherapie.
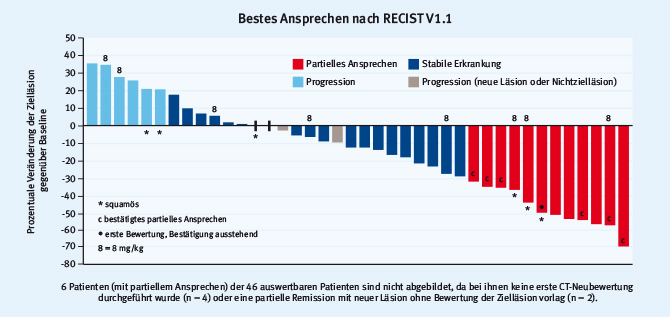 Abb. 3: Sacituzumab govitecan (IMMU-132) bei Patienten mit NSCLC: Bestes Ansprechen nach RECIST V1.1 (modifiziert nach [19]).
Abb. 3: Sacituzumab govitecan (IMMU-132) bei Patienten mit NSCLC: Bestes Ansprechen nach RECIST V1.1 (modifiziert nach [19]).Zusammenfassung
Zwar wurden auf dem diesjährigen ASCO keine spektakulären „practice changing“-Ergebnisse im Bereich Lungenkrebs vorgestellt, aber dennoch gab es eine Reihe wichtiger Studien. Diese lieferten zum einen neue Puzzleteile, um das noch relativ neue Gebiet der Immuntherapie mit den Checkpoint-Inhibitoren besser zu verstehen, und erhellten zum anderen das Feld der personalisierten Therapie auf der Basis von Treibermutationen mit einer differenzierten Betrachtung von Diagnostik und Therapie und einer damit verbundenen Optimierung von Therapiestrategien.
Es bleibt aber darauf hinzuweisen, dass die Mehrheit der Patienten mit metastasiertem NSCLC dennoch irgendwann in ihrem Krankheitsverlauf eine klassische zytostatische Therapie (Chemotherapie) benötigt. Auch werden Chemotherapien in der Immunoonkologie vermutlich eine wichtige Rolle als Backbonetherapie spielen – mit möglichen synergistischen Effekten, die bislang noch nicht vollständig geklärt sind. Es besteht deshalb weiterhin ein großer „unmet medical need“, um die Chemotherapie individualisierter und verträglicher zu gestalten.
Quellen
- Griesinger F et al. Clinical research platform into molecular testing, treatment and outcome of non-small cell lung carcinoma patients (CRISP): A prospective German registry in stage IV NSCLC AIO-TRK-0315.J Clin Oncol 34, 2016 (suppl; abstr TPS9108).
- Papadimitrakopoulou V et al. Phase III clinical trials of atezolizumab combined with chemotherapy in chemotherapy-naive patients with advanced NSCLC.J Clin Oncol 34, 2016 (suppl; abstr TPS9103).
- Baas P et al. Relationship between level of PD-L1 expression and outcomes in the KEYNOTE-010 study of pembrolizumab vs docetaxel for previously treated, PD-L1–Positive NSCLC. J Clin Oncol 34, 2016 (suppl; abstr 9015).
- Hui R et al. Long-term OS for patients with advanced NSCLC enrolled in the KEYNOTE-001 study of pembrolizumab (pembro).J Clin Oncol 34, 2016 (suppl; abstr 9026).
- Gadgeel SM et al. Pembrolizumab (pembro) plus chemotherapy as front-line therapy for advanced NSCLC: KEYNOTE-021 cohorts A-C.J Clin Oncol 34, 2016 (suppl; abstr 9016).
- Hall RD et al. Phase 3 study of platinum-based chemotherapy with or without pembrolizumab for first-line metastatic, nonsquamous non-small cell lung carcinoma (NSCLC): KEYNOTE-189.J Clin Oncol 34, 2016 (suppl; abstr TPS9104).
- Borghaei H et al. Nivolumab (nivo) vs docetaxel (doc) in patients (pts) with advanced NSCLC: CheckMate 017/057 2-y update and exploratory cytokine profile analyses.J Clin Oncol 34, 2016 (suppl; abstr 9025).
- Antonia SJ et al. Safety and clinical activity of durvalumab (MEDI4736), an anti-PD-L1 antibody, in treatment-naïve patients with advanced non‒small-cell lung cancer.J Clin Oncol 34, 2016 (suppl; abstr 9029).
- Verschraegen CF et al. Avelumab (MSB0010718C; anti-PD-L1) as a first-line treatment for patients with advanced NSCLC from the JAVELIN Solid Tumor phase 1b trial: Safety, clinical activity, and PD-L1 expression.J Clin Oncol 34, 2016 (suppl; abstr 9036).
- Infante JR et al. A phase Ib dose escalation study of the OX40 agonist MOXR0916 and the PD-L1 inhibitor atezolizumab in patients with advanced solid tumors. J Clin Oncol 34, 2016 (suppl; abstr 101).
- Levy BP et al. A phase II multicenter, randomized, placebo-controlled, double-blind study of CC-486 plus pembrolizumab (pembro) vs pembro plus placebo (PBO) in previously treated patients (pts) with locally advanced/metastatic non-small cell lung cancer (NSCLC).J Clin Oncol 34, 2016 (suppl; abstr TPS9107).
- Wakelee HA et al. Epidermal growth factor receptor (EGFR) genotyping of matched urine, plasma and tumor tissue from non-small cell lung cancer (NSCLC) patients (pts) treated with rociletinib. J Clin Oncol 34, 2016 (suppl; abstr 9001).
- Yang JC-H et al. Osimertinib activity in patients (pts) with leptomeningeal (LM) disease from non-small cell lung cancer (NSCLC): Updated results from BLOOM, a phase I study. Presented at Oral Abstract Session: Lung Cancer—Non-Small Cell Metastatic, ASCO 2016, Chicago, abstract 9002.
- Ahn M-J et al. Phase I study of AZD3759, a CNS penetrable EGFR inhibitor, for the treatment of non-small-cell lung cancer (NSCLC) with brain metastasis (BM) and leptomeningeal metastasis (LM). J Clin Oncol 34, 2016 (suppl; abstr 9003).
- Kim D-W et al. Brigatinib (BRG) in patients (pts) with crizotinib (CRZ)-refractory ALK+ non-small cell lung cancer (NSCLC): First report of efficacy and safety from a pivotal randomized phase (ph) 2 trial (ALTA). J Clin Oncol 34, 2016 (suppl; abstr 9007).
- Nokihara H et al. Alectinib (ALC) versus crizotinib (CRZ) in ALK-inhibitor naive ALK-positive non-small cell lung cancer (ALK+ NSCLC): Primary results from the J-ALEX study. J Clin Oncol 34, 2016 (suppl; abstr 9008).
- Solomon BJ et al. Safety and efficacy of lorlatinib (PF-06463922) from the dose-escalation component of a study in patients with advanced ALK+ or ROS1+ non-small cell lung cancer (NSCLC). J Clin Oncol 34, 2016 (suppl; abstr 9009).
- Cortot AB et al. Weekly paclitaxel plus bevacizumab versus docetaxel as second or third-line treatment in advanced non-squamous non-small cell lung cancer (NSCLC): Results from the phase III study IFCT-1103 ULTIMATE. J Clin Oncol 34, 2016 (suppl; abstr 9005).
- Camidge DR et al. Therapy of metastatic, non-small cell lung cancer (mNSCLC) with the anti-Trop-2-SN-38 antibody-drug conjugate (ADC), sacituzumab govitecan (IMMU-132). J Clin Oncol 34, 2016 (suppl; abstr 9011).
- Bildnachweis: „Chicago Loop skyline and Chicago River, IL, United States”: © Oleksandr Dibrova/Fotolia